Синтез триазолтиолов: как ацилировать тиосемикарбазид без активации карбоксильной группы?
Синтез триазолтиолов: как ацилировать тиосемикарбазид без активации карбоксильной группы?
В постоянно развивающейся области медицинской химии поиск эффективных и доступных методов создания биологически активных молекул остаётся одной из первостепенных задач. Исследование, проведённое сотрудниками Федерального исследовательского центра проблем химической физики и медицинской химии РАН (Черноголовка) было посвящено разработке такого метода для получения важного класса соединений — производных 1,2,4-триазол-3-тиола. Результаты этой работы опубликованы в журнале Molecules.
Производные 1,2,4-триазол-3-тиола уже хорошо известны учёным благодаря своему широкому спектру биологической активности. Эти сравнительно небольшие молекулы демонстрируют многообещающие результаты в исследованиях, направленных на создание противоопухолевых, противодиабетических и противовоспалительных средств. Они также проявляют активность в отношении ряда бактериальных и грибковых инфекций, включая такие серьёзные, как туберкулёз и пневмония. Однако доступ к этим соединениям часто осложняется сложностью их традиционного синтеза.
Классические подходы к получению триазолтиолов обычно требуют многостадийных синтезов, начинающихся либо с взаимодействия гидразидов с изотиоцианатами, либо с ацилирования тиосемикарбазидов с предварительной активацией карбоксильной группы, чаще всего через хлорангидриды. Эти методы, хотя и надёжны, могут быть трудоёмкими, требовать использования дорогих или труднодоступных реагентов и не всегда обеспечивают хорошие выходы целевых продуктов.
Коллектив исследователей поставил перед собой цель найти более прямой и универсальный путь. В основу работы легло ранее сделанное наблюдение: при реакции карбоновых кислот с тиосемикарбазидом в присутствии полифосфорного эфира (ПФЭ) в определённых условиях можно было получить аминотиадиазолы через образование промежуточного продукта ацилирования тиосемикарбазида. Задачей стало найти условия, которые позволили бы остановиться на стадии ацилирования и изменить дальнейшее направление реакции в сторону образования целевого триазола, при этом сведя к минимуму вероятность протекания конкурентной реакции образования тиадиазола.
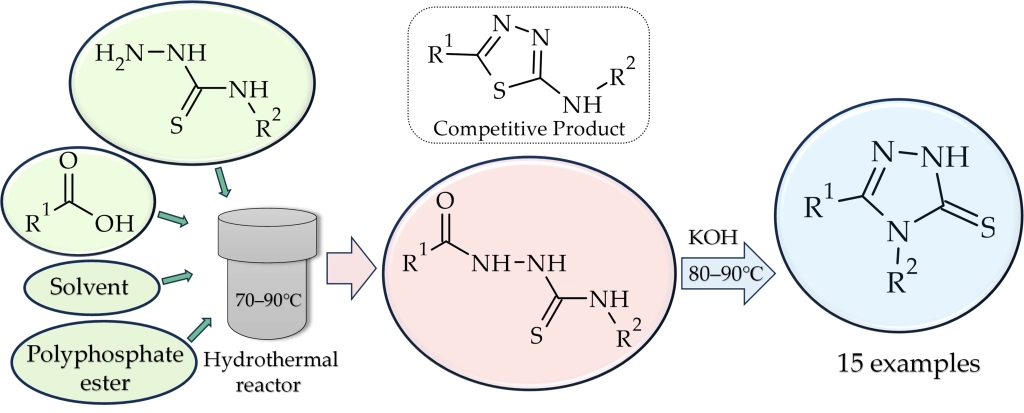
В результате проделанной работы был разработан новый подход к ацилированию тиосемикарбазида без стадии активации карбоновой кислоты. Карбоновая кислота и тиосемикарбазид взаимодействуют непосредственно в присутствии раствора ПФЭ в хлороформе. Ключевым моментом стало проведение этой реакции в герметичном сосуде — гидротермальном реакторе — при температуре порядка 70–90 °C. Это позволило подобрать максимально благоприятные условия для выделения нужного продукта ацилирования в чистом виде. Выделяемый при этом продукт в дальнейшем обрабатывается водным раствором щёлочи, что приводит к образованию целевого триазолтиола.
Разработанный подход оказался применим к разнообразным карбоновым кислотам, включая ароматические и содержащие гетероциклы, что позволило синтезировать пятнадцать целевых соединений, пять из которых были описаны впервые.
Главное достоинство метода — его простота и обход проблем, характерных для классических схем. Яркой иллюстрацией этого стал синтез соединения на основе триазолилпропионовой кислоты. Попытки получить это вещество стандартным путём через гидразид или хлорангидрид кислоты оказались безуспешными, приводя к сложным смесям продуктов. В то же время применение нового метода с использованием ПФЭ позволило получить целевое соединение в чистом виде без существенных трудностей.
Проведённая работа демонстрирует, что комбинация полифосфатного эфира как конденсирующего агента и гидротермального реактора как инструмента для проведения реакции открывает новые, более экономичные и эффективные пути синтеза ценных гетероциклических соединений. Этот стратегический подход может найти применение не только для получения триазолтиолов, но и в синтезе других классов биологически активных молекул, где требуются реакции ацилирования и циклизации.
Источник: ФИЦ ПХФ и МХ РАН.