Флеш-терапия пока лишь модное слово – Евгений Красавин
19 января 2022 14:26
Как была разгадана главная тайна радиобиологии
«Проблема относительной биологической эффективности, или ОБЭ, как ее называют для краткости, – одна из центральных в радиационной биологии, – рассказывает Евгений Красавин. – Она сводится к следующему вопросу: почему разные типы ионизирующих излучений обладают разной биологической эффективностью при одинаковой дозе облучения».
Речь идет в первую очередь о сравнении воздействия на живые ткани заряженных частиц – протонов и ионов – с гамма-квантами и рентгеновским излучением. Радиационная доза, то есть количество переданной излучениями энергии, физически может быть одинаковой, однако биологическое воздействие они оказывают разное.
Эта проблема возникла еще в 1930-40-е годы, когда были созданы нейтронные генераторы и выяснилось, что при действии этого вида излучения на клетки количество хромосомных аберраций (поломок) в три и даже в пять раз больше, чем при действии гамма-квантов в одинаковой дозе. Проблему пытались решить во многих лабораториях мира. Казалось понятным, что при пролете тяжелой заряженной частицы или нейтрона энерговыделение в микрообъеме совершенно отлично от того, что происходит при воздействии излучений фотонной природы, то есть гамма- и рентгеновского излучения.
«Физики-теоретики полагали, что для выяснения этих различий необходимо лишь детально рассчитать особенности выделения энергии разных видов излучений в микрообъемах, моделирующих генетические структуры, – рассказывает Евгений Красавин. – Возникла отдельная область науки – микродозиметрия. Совершенствовались методы расчета на ЭВМ, были исписаны горы бумаги, опубликована масса книг – однако проблема не была решена! Физики досконально все посчитали, но ряд параметров все равно не сходился. Стало ясно, что это тупик».
А дело оказалось в том, что клетка – не просто чувствительная мишень в процессе облучения, а является «живой» мишенью, которая и сама по себе реагирует на лучевое воздействие. Физический фактор, который можно рассчитать, действительно является определяющим, но существует и второй фактор – фактор биологической природы. Он связан с репарацией повреждений ДНК, которые возникают при радиационном воздействии на клетку. Все живое старается залечить полученные раны, и живая клетка – не исключение. В ней существуют механизмы, позволяющие репарировать, то есть ремонтировать, залечивать повреждения ДНК. Оказалось, что решать проблему ОБЭ надо было и на основе успехов микродозиметрии, и на основе анализа тех биологических процессов, которые протекают в клетках после облучения разными видами радиации.
Самый тяжелый вид генетических повреждений при облучении – это двунитевые разрывы ДНК, когда ее двойная спираль разрывается полностью. Именно такие повреждения приводят клетку к гибели. При этом физики рассматривали такие повреждения как однотипные, и в этом была главная ошибка.
При действии фотонных источников излучения возникают одиночные повреждения ДНК. Если представить структуру ДНК в виде скрученной в спираль веревочной лестницы, то одиночные повреждения – это поломка отдельных «перекладин», которые генетики называют основаниями, или разрыв одного из «канатов», между которыми эти перекладины-основания закреплены. Но вот пролетела тяжелая частица – и разорвалось сразу много ковалентных связей, произошел двунитевой разрыв ДНК, сломалась вся лестница, причем эти разрывы могут быть кластерными, то есть множественными.
«Мы в наших исследованиях показали, что при действии излучений различной природы индуцируются разные по качеству двунитевые разрывы ДНК, и эффективность их репарации клетками различна, – объясняет Евгений Красавин. – Оказалось, что при действии ионизирующих излучений электромагнитной природы в клетках формируются не только прямые двунитевые разрывы, но и так называемые энзиматические. Последние формируются в процессе репарации более простых повреждений – однонитевых разрывов, поврежденных оснований. При действии тяжелых заряженных частиц образуются, главным образом, прямые двунитевые разрывы, да к тому же, как позднее выяснилось, кластерного типа. На основании этого проблема ОБЭ была решена».
Российским ученым удалось математически описать всю последовательность цепи нарушений, которые формируются в генетических структурах после лучевого воздействия, и кинетику их восстановления сложной иерархичной репарационной системой. И это в свою очередь открыло дорогу к еще одному важнейшему достижению – к пониманию механизма образования радиационных мутаций.
«Нам удалось оценить, с какой вероятностью нарушения закрепляются в виде летального для клетки события или в виде мутации, – говорит ученый. – Это очень важно, потому что впервые была создана модель, описывающая механизм формирования мутаций в бактериальных клетках при лучевом воздействии. Когда индуцированный излучением мутационный процесс был обнаружен, то попытки его объяснения были предприняты выдающимися физиками-теоретиками. Гениальный Эрвин Шредингер предпринял такую попытку в книге «Что такое жизнь с точки зрения физики». Он рассматривал мутацию как результат выделения с какой-то вероятностью кванта энергии в участке гена, который тоже имеет квантовую природу, и в итоге происходит нарушение структуры гена. Теперь нам ясно, что закреплению мутации из премутационного повреждения предшествует целая цепь событий, на которую мы можем влиять».
На основании выполненных исследований был сделан следующий принципиальный вывод: биологическая эффективность ионизирующих излучений с разными физическими характеристиками на клетки с различным генотипом, оцениваемая по летальному действию, индукции генных и структурных мутаций, детерминирована двумя факторами: физическим фактором, определяющим особенности передачи энергии излучений и влияющим на характер индуцируемых повреждений ДНК, и биологическим – эффективностью работы индуцибельных и конститутивных систем репарации клеток. Роль биологического фактора является зависимой от качества излучения.
Ускоренные заряженные частицы как инструмент радиационной генетики
После того, как ученым Лаборатории радиационной биологии ОИЯИ удалось разгадать тайну ОБЭ, выдвинув идею, что при действии разных типов излучений индуцируются разные по качеству двунитевые разрывы ДНК, надо было продолжать исследования и изучать связанные с этим явлением эффекты.
«Радиобиологией я занимаюсь больше полувека, и наконец-то удалось дожить до времен, когда мы можем под специальным (конфокальным) микроскопом в отдельных ядрах определять количество двунитевых разрывов ДНК, оценивать их сложность и видеть, как идет в них репарация, – рассказывает Евгений Красавин. – Это делается путем использования иммуноцитохимических методов, которые позволяют визуализировать даже направление трека частицы в клетке как это делают физики в фотоэмульсии».
На приведенном выше слайде синим цветом показано ядро клетки, а также следы пролета заряженных частиц в виде цепочки двунитевых разрывов ДНК. Видно, сколько много повреждений возникает в одном ядре и как клетка старается ликвидировать эти последствия с помощью механизмов репарации.
Частицы, способные нанести такие повреждения, существуют в дальнем космосе в составе галактических лучей. Их влияние на безопасность будущих межпланетный перелетов – отдельная тема, о которой Евгений Красавин рассказал сайту РАН в интервью, опубликованном 14 декабря 2021 года. На Землю, к счастью, это излучение не проникает благодаря защите, создаваемой магнитосферой нашей планеты. Частицы с такими космическими энергиями на Земле можно получить только искусственно на ускорителях. Однако важность решения проблемы ОБЭ связана не только с разработкой вопросов защиты клетки от таких частиц, но и наоборот – с вопросом, как наиболее эффективным образом повредить живые клетки. Речь, разумеется, идет о раковых клетках. Лучевая терапия давно стала одним из основных способов лечения многих онкологических заболеваний, и способность протонов и других заряженных частиц более эффективно убивать клетки, привлекает к пучкам ускоренных заряженных частиц самое пристальное внимание. И тут оказался особенно важен учет фактора биологической природы – репарации повреждений ДНК.
«Я всегда говорил, что в свое время по разным причинам произошла недооценка эпохальности исследований, которые были посвящены изучению организации репарационной системы в живых клетках, – рассказывает Евгений Красавин. – Когда Уотсон и Крик описали структуру ДНК и получили за это Нобелевскую премию – это замечательно, но понимание того, что стабильность этой сложной информационной молекулы, которая постоянно реплицируется и подвергается повреждающему влиянию эндогенных и экзогенных факторов, нуждается в постоянном «надзоре» со стороны молекулярно-биохимической системы, которую представляет система репарации повреждений ДНК, пришло не сразу».
Как говорил выдающийся советский генетик Николай Владимирович Тимофеев-Ресовский, в живой клетке происходит постоянная конвариантная, то есть приводящая разными способами к одному результату, редупликация, самовоспроизведение ДНК. Ведь живая система – это не просто структура. Жизнь – это, прежде всего, воспроизводство себе подобного, и в живой клетке постоянно происходит репликация ДНК. Количество ошибок при этом может быть огромным, но эти ошибки постоянно отслеживаются и исправляются. Для этого в клетках существует система обратной связи со сложной иерархией процессов, которая осуществляет эту функцию.
«Фактически Уотсон и Крик, открывшие структуру ДНК в виде двойной спирали, описали, я бы сказал, механистическую сторону организации живой материи, – говорит Евгений Красавин. – А динамическая сторона – это система обратных связей и механизмов репарации. Эта репарационная система является основополагающей для стабилизации генома как такового. Мы показали иерархичность организации репарационного процесса у клеток бактерий, когда разные системы в этой иерархии включаются в репарационный процесс в зависимости от степени тяжести и характера генетических повреждений».
Важно заметить, что помимо своей теоретической важности это положение имеет практическое значение для создания более эффективных методов лучевой терапии.
О недостатках метода грубой «физической силы»
В общем виде методы лучевой терапии основаны, как известно, на двух важнейших принципах. Во-первых, это обеспечение конформности характера передачи энергии ионизирующего излучения, то есть умение максимально сосредоточить дозу в облучаемом объекте, в данном случае – в опухоли. А во-вторых, это способность лучевого фактора формировать в облучаемых раковых клетках те повреждения, которые должны приводить их к гибели. В первую очередь это самые тяжелые повреждения – двунитевые разрывы ДНК.
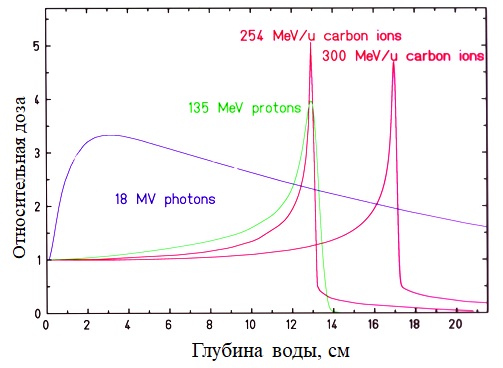
Как реализовать конформность? При использовании фотонного излучения – рентгеновских лучей или гамма-квантов – максимальная доза передается на поверхностные ткани, а если опухоль залегает глубоко, то там доза уже значительно меньше (см. синюю кривую на графике выше). А в случае действия заряженных частиц максимальная энергия излучения передается тканям в конце пробега частиц в так называемом пике Брэгга, в конце пробега, где частица сильнее всего тормозится. Благодаря этому, подбирая энергию частиц, можно регулировать глубину их проникновения в живые ткани, на которой они отдадут максимум дозы.
Как инактивировать клетку, входящую в состав ткани млекопитающих? Чтобы клетка погибла с вероятностью, близкой к единице, нужно чтобы в ее ядре сформировалось порядка 40 неотрепарированных двунитевых разрывов ДНК. По сравнению с фотонами ускоренные заряженные частицы формируют в 2–2,5 раза больше двунитевых разрывов ДНК на единицу поглощенной дозы. С целью повысить эффективность методов лучевой терапии, что особо важно в случае так называемых радиорезистентных, то есть слабо чувствительных к лучевому воздействию, опухолей, в некоторых развитых странах (Япония, Германия) были построены медицинские ускорители ядер углерода. Ядра углерода тяжелее нейтронов и способны нанести гораздо большие повреждения клетке. Но подобные установки – сложные и крайне дорогие как в создании, так и в эксплуатации машины.
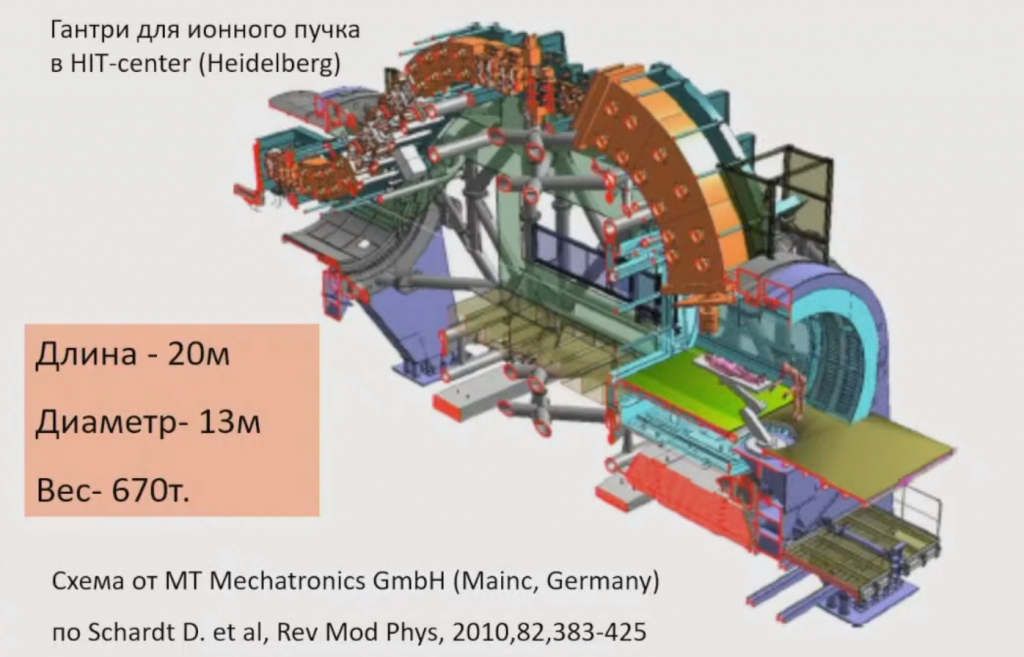
На слайде выше показан лишь один из элементов углеродной машины для терапии рака – так называемый гантри, устройство, используемое для нацеливания медицинского пучка на зафиксированного пациента. В установках для лучевой терапии гантри изменяет направление пучка за счет магнитов.
«В протонных машинах это тоже достаточно большое устройство, но чтобы развернуть тяжелый углеродный пучок, нужна махина с четырехэтажный дом длиной 20 м и высотой 13 м, – рассказывает Евгений Красавин. – Вес – почти 700 т. И это помимо самого ускорителя. При этом результаты клинического использования таких устройств, как свидетельствуют специалисты, пока весьма скромные».
Идеальное убийство
«Мы поставили целью попытаться реализовать идею, которая заключается в следующем: а нельзя ли каким-то образом модифицировать процессы, которые происходят в живых клетках, чтобы трансформировать легкие повреждения ДНК в двунитевые разрывы, – говорит Евгений Красавин. – Ведь однонитевых разрывов возникает на порядок больше, а повреждений оснований, тех самых «перекладин лестницы» ДНК, – больше еще на порядок. На один двунитевой разрыв ДНК приходится 10 однонитевых и 100 модифицированных, то есть поврежденных, оснований».
Однонитевой разрыв не приводит к гибели клетки. Такие повреждения эффективно репарируются. И тогда специалисты лаборатории под руководством Евгения Красавина решили использовать один агент, которым они заинтересовались еще лет 40 назад при решении проблемы ОБЭ. Это арабинозидцитозин – хорошо известный препарат, который применяется для химиотерапии при лечении лейкозов.
Действие этого агента заключается в том, что при возникновении однонитевого разрыва ДНК он как бы консервирует его, не дает его исправить с помощью обычного механизма репарации. Но клетка «не терпит» однонитевого состояния ДНК, поэтому есть ферменты, которые начинают атаковать оставшуюся целой нить и превращают такое повреждение в двунитевой разрыв, чтобы затем «отремонтировать» ДНК с помощью другого механизма. Так происходит трансформация однонитевых разрывов в двунитевые.
Когда таких разрывов относительно немного, клетка успевает их «склеивать». Но если после облучения все однонитевые разрывы, которых возникает в 10 раз больше, превращаются в двунитевые, механизмы репарации не справляются с ситуацией, и клетка погибает. Выход однонитевых разрывов и модифицированных оснований при облучении клеток фотонными пучками и протонами с достаточно высокой энергией весьма высок. Следовательно, можно попытаться добиться с помощью обычного протонного пучка той же эффективности лечения радиорезистентных опухолей, что и с помощью углеродных пучков, при том что стоимость протонных машин на порядки меньше. При этом повышенная эффективность методики, когда химический агент как бы усиливает действие излучения, позволяет использовать более щадящие для пациента режимы облучения. Более того, такой же эффект наблюдается не только при облучении протонами или другими легкими частицами, но и при гамма-облучении.
Возникает вопрос: а нужно ли строить дорогущие углеродные машины или можно двигаться по другому пути, влияя на внутреннюю иерархию репарационных процессов, на молекулярную «машинерию» клетки, совершенствуя методику такого влияния для повышения эффективности терапевтического действия ионизирующих излучений? Вместо применения грубой «физической силы» более мощного пучка, можно использовать силу знаний.
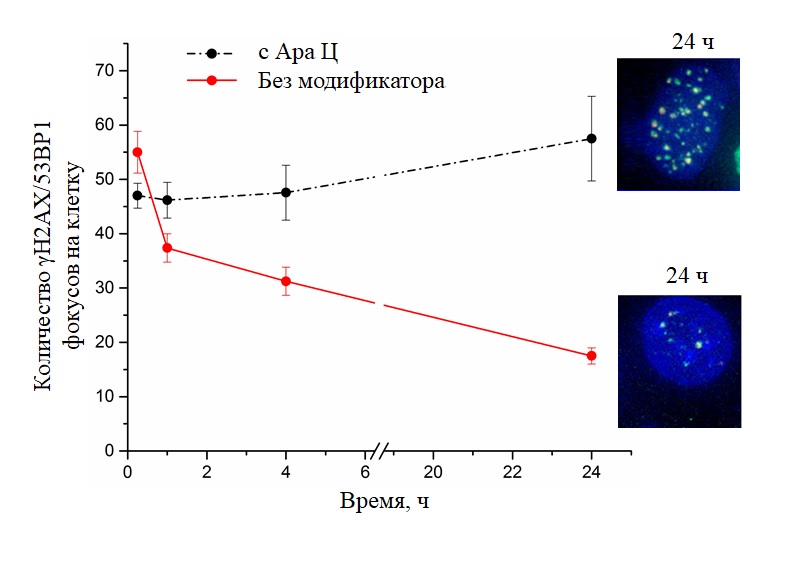
Первые результаты в этом направлении были получены в экспериментах in vitro – «в пробирках», на культурах клеток. В экспериментах in vitro как в нормальных, так и в опухолевых клетках количество двунитевых разрывов ДНК (светлые точки в клеточных ядрах) в присутствии арабинозидцитозина (черная кривая) резко увеличивается. Значит, чувствительность клеток к действию излучения в этих условиях возрастает. Данные, представленные на графике выше, получены в экспериментах с клетками глиобластомы. Это крайне тяжелая форма злокачественной опухоли головного мозга. После этого надо было все это проверять in vivo – в экспериментах на животных.
«Мы, конечно, могли бы это делать сами, но решили, что к результатам будет больше доверия, если этим займутся профессионалы Медицинского радиологического научного центра им. А.Ф. Цыба в Обнинске, – рассказывает Евгений Красавин. – Мышкам в лапку ввели клетки меланомы – крайне агрессивной и радиорезистентной опухоли. Опухоль подращивалась до определенного размера – где-то 50 мм3, после чего производилось облучение медицинскими протонами в дозе 10 Грей. Были контрольные животные, которых не облучали, были те, которых просто облучали, и те, которых облучали в сочетании с введением арабинозидцитозина».
Где-то через 30 суток вся контрольная группа погибла – у животных формировались огромные опухоли, размером порядка 5000 мм3. Мыши, которые были просто облучены протонами, продолжали жить, опухоль у них росла медленнее. И значительно меньше был размер опухоли у животных, которым сделали облучение с введением арабинозидцитозина.

Результаты этих экспериментов были представлены в докладе Президента РАН Александра Сергеева на общем собрании членов РАН в числе важнейших научных достижений, полученных российскими учеными в 2019 г.
Воздействие на процессы репарации при облучении опухолевых клеток – не новая идея, но влияние на уровне формирования повреждений ДНК продемонстрировано российскими учеными впервые в мире, причем с использованием официнального, то есть продающегося в аптеках и многократно апробированного в клинике препарата. Он многие годы применяется в онкологической практике, но в таком сочетании с действием ионизирующей радиации – особенно протонов – его никогда не изучали.
Как подчеркнул Евгений Красавин, это совершенно новый взгляд на проблему. Такой подход очень продуктивен, поскольку в сочетании с другими химическими агентами, влияющими на различные этапы репарационного процесса, возможна модификация лучевых реакций нормальных и опухолевых клеток в широких пределах.
«У нас в лаборатории сейчас успешно проводятся такого рода исследования, – говорит ученый. – В прошлом году мы получили патент на предложенный метод и ожидаем решения на второй патент, касающийся опухоли меланомы».
Принципиальным здесь является то, что было показано: возможен путь повышения эффективности лучевой терапии с помощью вмешательства во внутриклеточную машинерию, а не только лобовым путем через физику воздействующего излучения. Тем не менее «силовой» подход продолжает культивироваться. Разговоры о необходимости строительства углеродного комплекса в России утихли, зато продолжают звучать дифирамбы в честь флеш-терапии.
Модное слово
«Если вы загляните в интернет, то там вокруг флеш-терапии творится настоящий ажиотаж, – говорит Евгений Красавин. – Революция в лучевой терапии! Все вылечим! Какие-то уже частные компании появились, которые предлагают свои услуги».
Адепты флеш-терапии утверждают, что если взять фотонный или протонный пучок чрезвычайно малой длительности (десятки микросекунд) и создающий в импульсе очень высокую дозу в облучаемых тканях, то при действии излучений с такими физическими характеристиками на злокачественные опухоли достигается особый эффект, который заключается в максимальном сохранении здоровых тканей и максимальной гибели облучаемых раковых клеток.
«Специалистам-радиобиологам совершенно непонятно такое утверждение: за счет каких фундаментальных радиобиологических процессов реализуется различие в радиочувствительности нормальных и опухолевых клеток, претерпевающих такого типа лучевое воздействие? – задает вопрос Евгений Красавин.
По словам ученого, в какой-то мере можно рассматривать специфику реализации в этих условиях «кислородного эффекта», который действительно является одним из наиболее проблемных вопросов при стандартной лучевой терапии. «Кислородный эффект» заключается в том, что большие по размеру опухоли, как правило, хуже снабжаются кислородом током крови. Центральная часть опухолевой ткани содержит пул гипоксических (со сниженным парциальным давлением кислорода) клеток, радиочувствительность которых в 2–3 раза меньше по сравнению с нормально оксигенированными (насыщенными кислородом) клетками.
«При обсуждении возможных радиобиологических механизмов, лежащих в основе флеш-эффекта, необходимо иметь сравнительные данные о реакции аноксических и нормально оксигенированных клеток при флеш-облучении, – говорит Евгений Красавин. – Однако я такие данные не встречал. Касаясь вопросов флеш-терапии, я хотел бы упомянуть результаты исследований, которые привел в своем докладе главный онкорадиолог России профессор Евгений Витальевич Хмелевский в своём докладе на VIII Съезде по радиационным исследованиям (Москва, октябрь 2021)».
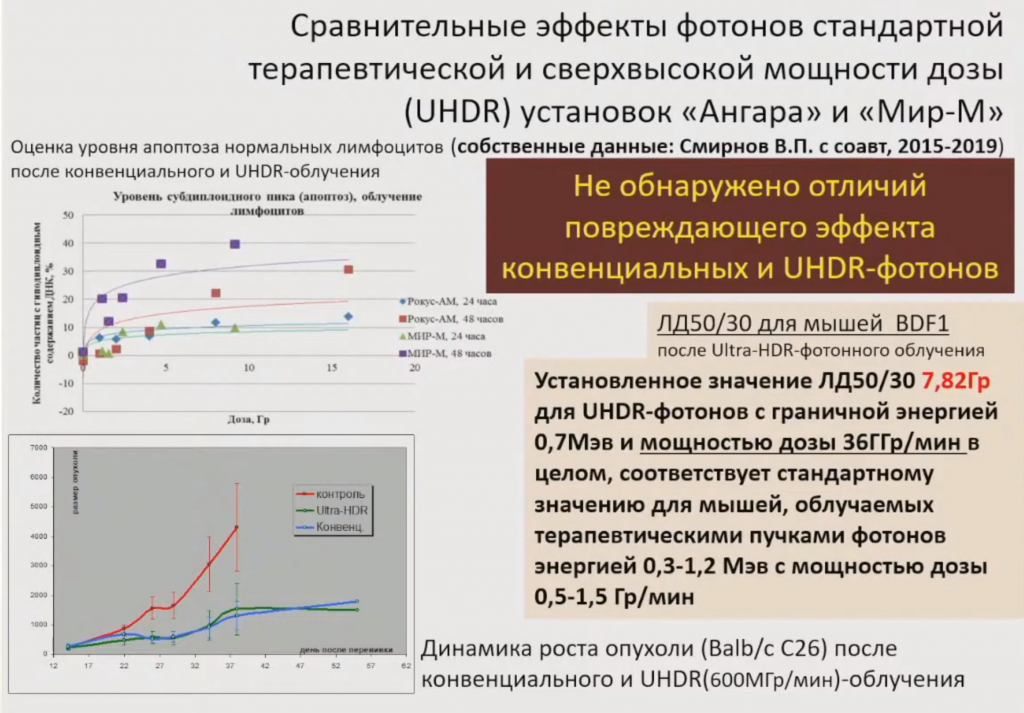
«Главный вывод, который был сделан на основании полученных результатов: не обнаружено отличий повреждающего эффекта пучков конвенциальных и флеш-фотонов (UHDR), – говорит Евгений Красавин. – Адепты рекламируют чудодейственные свойства флеш-терапии убивать раковые клетки и щадить здоровые, но никто не пишет, с помощью какого механизма этот эффект осуществляется. Радиобиологических основ нет».
Возможное преимущество флэш-терапии пока сводится лишь к тому, что облучение происходит быстро, за один сеанс, а не растягивается на несколько дней или даже месяцев. Но для флэш-ускорителей, как и в случае углеродной терапии, также требуются очень дорогие установки, а какая-то особая их эффективность пока вызывает сомнения.
«Мы не закрываем вопрос об эффективности флеш-терапии полностью, но будьте любезны – покажите радиобиологические данные, полученные с помощью конвенциальных и флеш-пучков, и механизмы, с помощью которых эта эффективность проявляется, – говорит Евгений Красавин. – Но слово красивое. Всем нужны деньги на исследования, а тут модное, популярное слово, деньги под него дают. Вот и все».
Что дальше
Исследования обнаруженного лабораторией под научным руководством Евгения Красавина эффекта будут продолжены, и не только с модификаторами, влияющими на трансформацию одних повреждений ДНК в другие, но и с комбинацией таких модификаторов с другими агентами, которые влияют на репарационные процессы в клетках. Формируется новое направление исследований – разработка способов повышения эффективности лучевой терапии методами биологического, а не физического плана.
По словам ученого, впереди большая работа. Необходимо изучить, какие формы раковых заболеваний можно лечить таким способом. Для каждого типа опухоли нужно подобрать свою концентрацию введения лекарства и свои дозы. Это длительный процесс.
Специалисты лаборатории думают о способах блокировки определенных этапов репарации, что еще более усилит эффект. Ведь пока найден лишь метод увеличения количества начальных повреждений в клетке, но при этом идет встречный процесс их репарации. А ведь есть способы заблокировать репарацию двунитевых разрывов ДНК, и в лаборатории уже получены первые результаты в этом направлении. Огромный фронт исследований касается поиска векторных молекул, которые селективно доставляли бы используемые агенты в клетки-мишени опухоли.
«Надо не просто доставлять дозу излучения в опухолевую ткань, а элегантно воздействовать на определенные механизмы репарационного процесса, усиливая эффект лучевого воздействия», – подводит итог Евгений Красавин.
Подготовил Леонид Ситник. Редакция сайта РАН.
