ИБГ РАН работает над идеальным лекарством против рака
ИБГ РАН работает над идеальным лекарством против рака
Нанотранспортер, созданный в Институте биологии гена (ИБГ) РАН, способен доставить лекарство не просто к нужной клетке, а в ядро этой клетки. За счет этого эффективность лечения повышается в тысячи раз. Об этом рассказал заведующий лабораторией молекулярной генетики внутриклеточного транспорта ИБГ РАН, член-корреспондент РАН Александр Соболев на Международном семинаре «Развитие радиохимии и получение медицинских изотопов» в Институте ядерных исследований РАН 14 января 2022 г.
Свой доклад Александр Соболев начал с цитаты из статьи 1928 года, соавтором которой был Клод Рего, один из родоначальников лучевой терапии. Вместе с Марией Склодовской-Кюри он возглавлял созданный в 1913 году Институт Кюри: Склодовская-Кюри ведала физико-химической частью, а Клод Рего – медико-биологической.
Вот какими словами в этой статье определялось идеальное радиохимическое средство для лечения онкозаболеваний: «Идеальный агент для терапии рака должен состоять из тяжелых элементов, испускающих излучения на молекулярные расстояния, и который должен вводиться в организм и селективно внедряться в протоплазму тех клеток, которые надлежит уничтожить».
«Хочу обратить внимание на то, что, люди находившиеся у истоков радиологии, примерно 100 лет тому назад считали идеальным, с их точки зрения, терапевтическим радиофармпрепаратом, – подчеркнул Александр Соболев. – К этому подходу мы вернулись только в последние десятилетия. И обусловлено это в немалой степени средствами доставки радионуклидов».
Применение радиохимических препаратов при лечении онкологических заболеваний основано на способности ионизирующего излучения убивать раковые клетки. Для этого в организм вводятся радионуклиды, то есть радиоактивные атомы. Это радиоактивные изотопы различных веществ, которые при распаде ядер могут излучать, например, альфа- или бета-частицы. Соответственно, их называют альфа- и бета-эмиттерами. Кроме того, есть еще радиоизотопы, атомы которых являются излучателями, то есть эмиттерами, так называемых электронов Оже.
Электроны Оже испускаются атомом в результате эффекта, названного в честь французского физика Пьера Оже. При образовании в одной из внутренних электронных оболочек атома вакансии, то есть при выбытии по какой-либо причине электрона, на нее переходит электрон с внешней оболочки, а избыток образовавшейся при этом энергии передается третьему электрону, который благодаря этому может покинуть атом, становящийся таким образом источником ионизирующего излучения. Именно на эффективное использовании эмиттеров электронов Оже для лечения рака сделан акцент в докладе Александр Соболев.
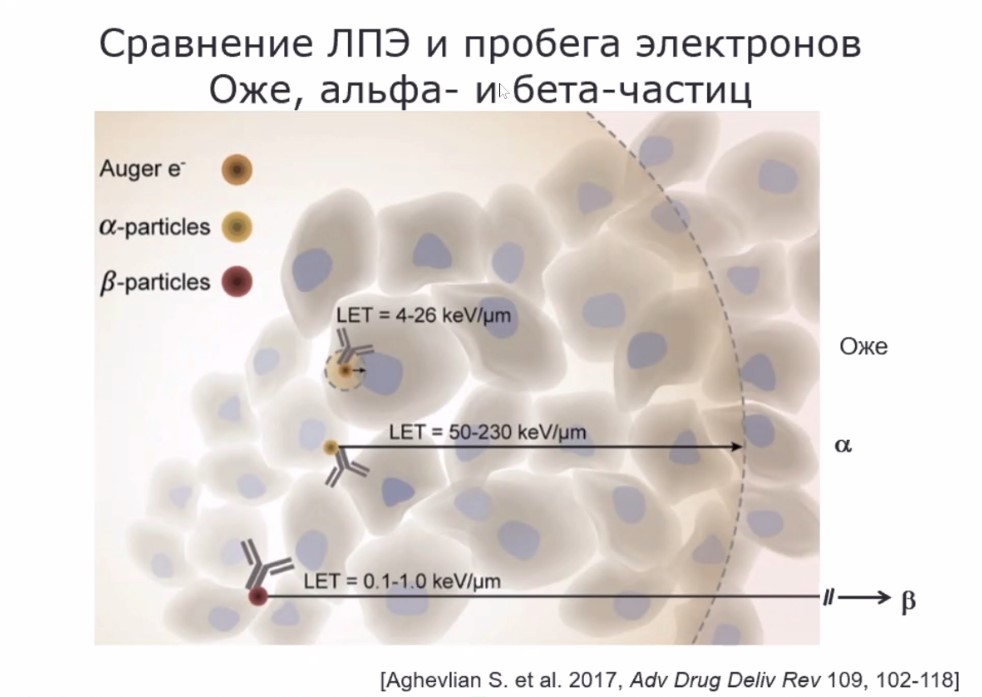
Преимущества эмиттеров электронов Оже можно понять, если сравнить их с альфа- и бета-эмиттерами по длине пробега испускаемых частиц и их линейной передачи энергии (ЛПЭ), а передача энергии от частицы веществу - это и есть доза радиации (см. рис. выше).
«В случае бета-эмиттеров длина пробега составляет многие десятки клеток, среди которых, естественно, могут бить и нормальные клетки, которые повреждать либо нет необходимости, либо опасно, если говорить, скажем, об опухолях мозга, особенно у детей, – рассказывает Александр Соболев. – Если говорить об альфа-эмиттерах, то это пробеги порядка нескольких клеточных диаметров – от 3 до 5 в зависимости от энергии. А если мы говорим об электронах Оже, то в этом случае при достаточно приличном ЛПЭ, находящейся ближе к ЛПЭ альфа-частиц, пробег получается меньше клеточного диаметра. То есть здесь есть возможность обеспечить точечное и выборное поражение именно клетки-мишени».
Ученый особо подчеркнул, что на один распад эмиттера электронов Оже приходится до нескольких десятков испускаемых электронов, то есть получается достаточно большая доза на распад. Александр Соболев сравнил это воздействие с нановзрывом, приводящим к множественным двунитевым разрывам ДНК, которые клетки, в том числе и раковые, не способны репарировать (восстановить), что обеспечивает гарантированное уничтожение клетки. При этом подавляющее большинство испускаемых электронов Оже, более 90 %, имеют средний пробег меньше 100 нм, при том что размеры клеток измеряются микронами и десятками микрон (1 мкр = 1000 нм).
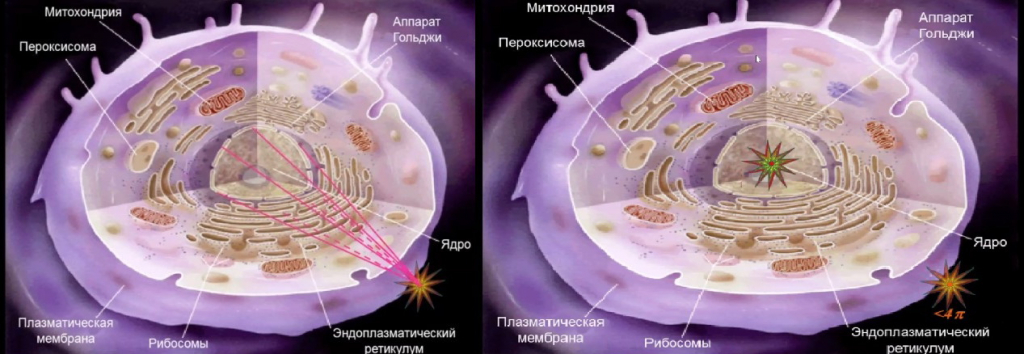
Эмиттеров электронов Оже известно достаточно много, и многие из них давно применяются в медицине, но в основном для целей диагностики. Их терапевтическому применению препятствует как раз меньший, чем размер клетки, пробег. Находясь за переделами клетки, даже на ее поверхности, он не может на нее эффективно воздействовать, хотя, в принципе, доставка в ядро клетки полезна и в том случае, если радионуклид, например – альфа-эмиттер, может убивать раковую клетку даже находясь рядом с ней, а не внутри.
Согласно пояснениям Александра Соболева, при нахождении эмиттера на поверхности клетки будут эффективны только те частицы, которые испущены в достаточно узком телесном углу (вверху слева), поскольку только их треки пройдут через клеточное ядро. Остальные треки будут на порядки менее эффективны с точки зрения поражения клетки-мишени. Но если есть возможность доставить эмиттер внутрь клеточного ядра, то можно наблюдать 4π-эффекты (полный телесный угол, то есть полная сфера, равен 4 π стерадиан).
Таким образом можно добиваться большего эффекта меньшим количеством радионуклидов, введенных в организм. Но в случае эмиттеров электронов Оже, которые являются «оружием ближнего боя», их терапевтическое действие вообще возможно лишь при их доставке непосредственно в ядро клетки. Созданием средств для такой доставки занимается лаборатория, которую возглавляет Александр Соболев.
«Таргетную радиотерапию с использованием эмиттеров электронов Оже уже более 20 лет пытаются использовать для лечения рака, – говорит ученый. – Но все клинические испытания затормозились в 2014 году. Основная причина - отсутствие достаточно эффективных средств доставки не просто в нужную клетку-мишень, но внутрь наиболее радиочувствительной органеллы в этой клетке – в клеточное ядро».
Для решения этой проблемы российские ученые решили не создавать специальную «транспортную систему» для доставки радионуклида в ядро клетки, а «продавать билеты для проезда на внутриклеточном транспорте», который уже создала природа.
«Наш подход состоит в том, чтобы использовать в своих интересах те естественные процессы, которые проходят в клетках, – рассказывает Александр Соболев. – В них есть система внутриклеточного транспорта, отлаженная так, как не снилось железным дорогам Германии. Задача состоит не в том, чтобы придумать какие-то двигающиеся системы, а в том, чтобы создать такие молекулы, которые несли бы адреса, как пачку билетов для поездки с пересадками, чтобы та молекулярная машинерия, которая уже есть в клетках, их считывала и отправляла то, что нужно, туда, куда нужно».
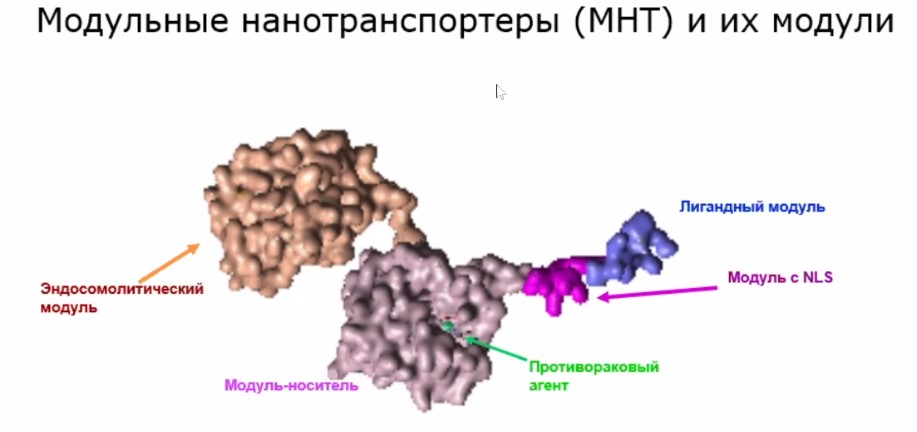
Для осуществления этой идеи были синтезированы искусственные молекулы, которые Александр Соболев назвали модульными нанотранспортерами (см. рис. выше), потому что они состоят из нескольких частей – модулей, которые могут модифицироваться и заменяться в зависимости от задачи.
«Каждый модуль выполняет свои функции, – говорит ученый. – Скажем, лигадный модуль узнает определенный тип-клеток по тому, какие есть на ее поверхности молекулы, способные втягиваться внутрь клеток. Есть такие молекулы, которые представлены либо исключительно на раковых клетках, либо преимущественно на них. Таким образом опознаются раковые клетки».
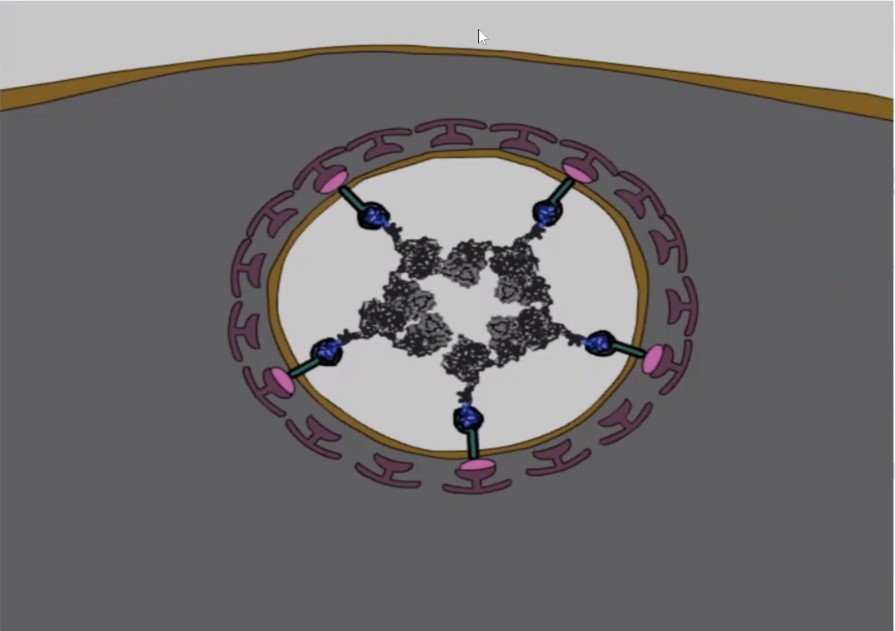
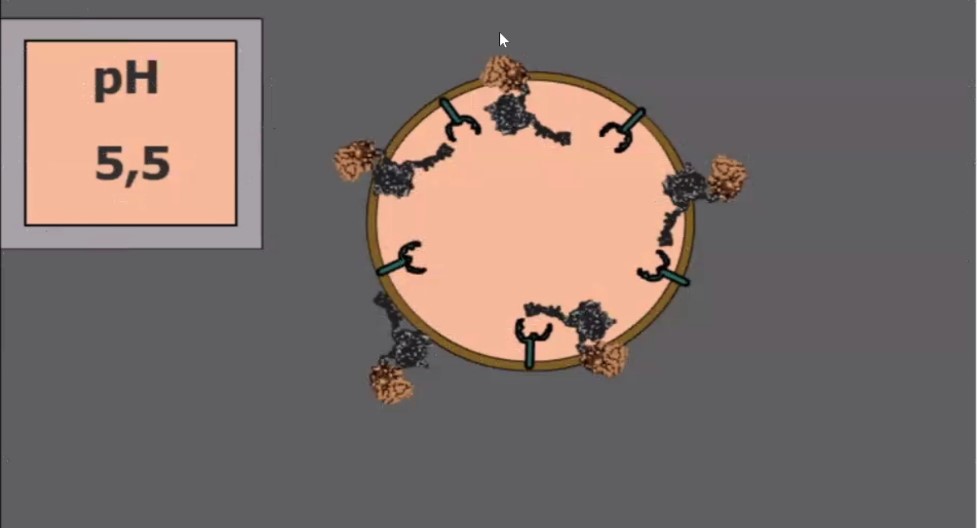
При предъявлении этого «билета» молекулы-нанотранспортеры вместе со своим грузом втаскиваются внутрь клетки с помощью ее же собственной молекулярной машинерии, и оказываются в замкнутых пространствах, называемых везикулами (см. рис. выше). По словам Александра Соболева, несколько нобелевских премий последнего десятилетия были связаны с исследованиями, посвященными этому очень интересному «виду транспорта».
«Из этих везикул надо выбраться, и для этой цели существуют еще один модуль –эндосомолитический, – говорит ученый. – В зависимости от условий, в данном случае – от кислотности среды, он меняет свою конформацию (расположение атомов в молекуле – прим. ред.) и делает дырки в этих везикулах, благодаря чему молекулы выходят из них внутрь клетки».
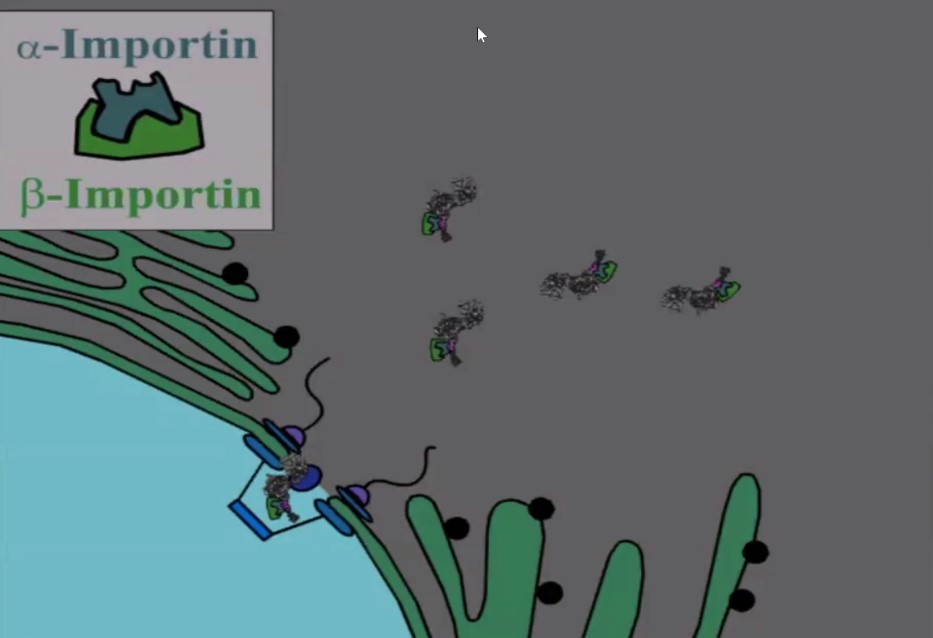
Следующий «билет» – это модуль с NLS, аминокислотной последовательностью, в которой содержится «адрес» доставки. Эта последовательность связывается с белками, которые называется импортинами, благодаря чему вся молекула протаскивается внутрь клеточного ядра. Так набор «билетов» обеспечивает доставку нужной молекулы к месту назначения.
Структуру этих молекул-нанотранспортеров российским ученым удалось определить относительно недавно, но эксперименты по их практическому применению уже идут полным ходом.
«Оказалось, на примерах таких эмиттеров электронов Оже, как йод-125 или галлий-67, что уже в первый час введения больше 60 % радиоактивности оказывается не просто внутри клетки, а внутри клеточного ядра, – рассказывает Александр Соболев. – Соответственно, если сравнивать, скажем, йод-125, галлий-67 или индий-111, которые находятся на поверхности клетки, с такими же изотопами, которые введены в ядро клетки с помощью нанотранспортеров, то оказывается, что эффективность поражения раковых клеток увеличивается вплоть до трех порядков, то есть не в разы, а в тысячи раз».
Учеными уже проводятся испытания эффективности новой методики для лечения онкозаболеваний. Вот только один пример. По данным Александра Соболева, больше половины пациентов в США и Западной Европе, которые претерпели хирургическое вмешательство по поводу мышечно-неинвазивного варианта рака мочевого пузыря, в течение 5 лет снова оказываются на операционном столе. Одна из причин состоит в том, что это мультифокальные, то есть рассеянные по уротелию – внутренней выстилке мочевого пузыря – микроопухоли. То есть вместо одной большой опухоли приходится сталкиваться с множеством мелких, которые невозможно удалить хирургически без остатка.
«Мы решили проверить эффективность нашей методики в вариантах раковой опухоли мочевого пузыря, – говорит Александр Соболев. – Использовалась экспериментальная опухоль, то есть клетки человеческого урателия с опухолью прививают иммунодефицитным мышам. Если в опухоль вводится нанотранспортер с индием-111, то время его полуудержания в организме получается очень большое, порядка 4 суток, то есть даже больше, чем период полураспада индия-111, что очень хорошо. Если же индий-111 вводится обычным образом, то время полуудержания составляет порядка 10 минут. Это абсолютно недостаточно для достижения какого бы то ни было эффекта. При этом в других тканях практически не обнаруживается радиоактивности, а однократная монотерапия, то есть без каких-либо дополнительных методов лечения, дает торможение роста опухоли на примерно 90 %».
Разумеется, до внедрения этой методики в медицинскую практику пройдут еще многие годы исследований и клинических испытаний, но ученые уже думают над способами ее усовершенствования, чтобы получить больший эффект меньшими дозами.
«С нашей точки зрения, и мы этим уже начали заниматься, представляют интерес другие внутриклеточные мишени – митохондрии, – рассказывает Александр Соболев. – Клеточные ядра – уникальная структура. В основном на клетку приходится единственное ядро с двойным набором ДНК. Но хотя митохондрии – это множественная структура, если повредить их наружную мембрану, то в этом случае они запускают запрограммированную клеточную гибель. Не только все мы смертны, но и наши клетки запрограммированы на умирание, и можно их гибель ускорить или замедлить».
То есть в данном случае речь идет не о прямом «убийстве» раковой клетки излучением, а о запуске естественного процесса ее самоуничтожения.
«Если доставить те же эмиттеры электронов Оже на поверхность митохондрий, то существует вероятность, что мы запустим процесс, в результате которого клетка просто сама себя съест, – говорит Александр Соболев. – Это безотходное производство, что на самом деле удобно – нет воспалительных процессов. Но, естественно, нужно средство доставки».
Говоря о других направлениях перспективных исследований, ученый отметил, что созданные в лаборатории нанотранспортеры благодаря своей модульности позволяют заниматься доставкой не только радионуклидов, но и самых разных биологически активных соединений.
«В частности, нам удалось доставить полипептиды, которые влияют на процессы репарации клеток, – говорит Александр Соболев. – То есть можно, с одной стороны, усилить токсический эффект радионуклидов, подавив репарацию раковых клеток, а можно защитить нормальные клетки, активируя в них процессы, связанные с репарацией или с иными путями защиты от ионизирующих излучений. Перспективы достаточно вдохновляющие».
Подготовил Леонид Ситник, редакция сайта РАН.