Иммуностимулирующие РНК снижают риск фиброза лёгких при терапии рака и вирусных инфекций
Иммуностимулирующие РНК снижают риск фиброза лёгких при терапии рака и вирусных инфекций
Исследователи из Института химической биологии и фундаментальной медицины СО РАН разрабатывают новый метод лечения рака и инфекций с использованием молекул иммуностимулирующих РНК. Эти молекулы помогают организму бороться с болезнями и предотвращают опасное осложнение — фиброз лёгких. Статья об этом опубликована в международном журнале Biochimie.
«Главная идея новой технологии заключается в способности иммуностимулирующих РНК повышать возможность организма защищаться от заболевания самостоятельно, не вызывая значительных побочных эффектов. ИсРНК запускают активность иммунной системы и усиливают защиту против инфекций и болезней», — рассказывает главный научный сотрудник лаборатории биохимии нуклеиновых кислот ИХБФМ СО РАН доктор биологических наук Елена Леонидовна Черноловская.

Эти молекулы действуют сразу несколькими путями. Одна из ключевых функций — стимуляция выработки интерферонов первого типа, специальных белков, которые блокируют размножение вирусов и поддерживают иммунитет. Потенциал применения исРНК распространяется не только на борьбу с онкологическими заболеваниями, но и на лечение вирусных инфекций. Попав в организм, молекула запускает выработку широкого спектра сигнальных белков — цитокинов, часть из которых тормозит опухолевое деление клеток, другие же, наоборот, могут способствовать воспалительным процессам. При этом важно отметить, что эффект исРНК определяется именно составом выделяемых цитокинов. Конкретная молекула, которую исследуют в ИХБФМ СО РАН, обладает уникальным спектром: высокий уровень интерферонов первого типа сочетается с низким уровнем провоспалительных веществ, что делает её особенно перспективной.
Фиброз лёгких представляет серьёзную опасность, поскольку часто выступает осложнением других заболеваний. Часто он возникает у больных онкологией из-за химиотерапевтического лечения, а также у рабочих, подверженных воздействию частиц тяжёлых металлов и кремния в промышленной среде.

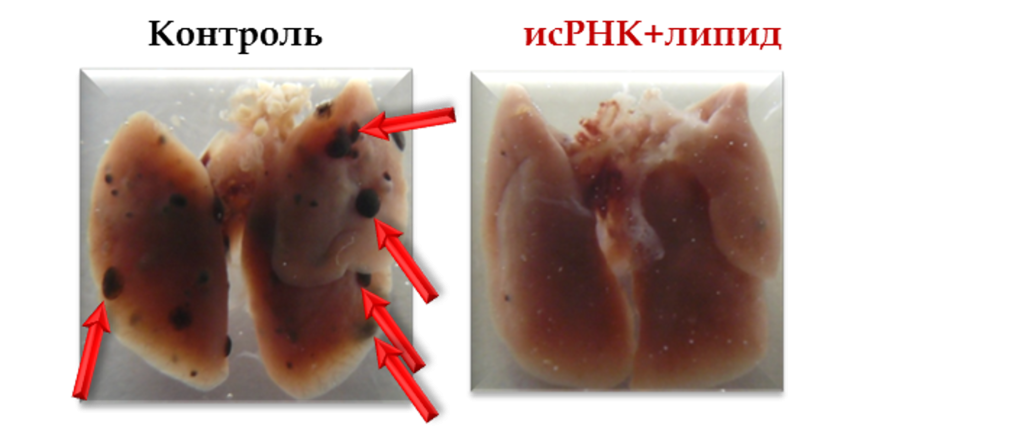
«Для изучения воздействия исРНК на процессы фиброза легкого мы выбрали две экспериментальные модели. Первая имитировала побочные эффекты химиотерапии с использованием препарата „Блеомицин“ при злокачественных новообразованиях. Вторая модель отражала последствия инфекционных поражений дыхательной системы, вызванные липополисахаридом. Мы проанализировали влияние иммуностимулирующей РНК на динамику формирования фиброза у мышей. Оказалось, что такая терапия не только не усиливает проявления болезни, но напротив — способствует снижению степени поражения тканей и предупреждает дальнейшее развитие фиброза», — отметила Елена Черноловская.
Исследователи проверяли эффективность препарата как профилактически, так и терапевтически, выявив оптимальную схему введения, при которой наблюдалось максимальное улучшение показателей здоровья животных. Эксперимент проводился на нескольких группах грызунов, причём в каждую группу входило не меньше шести-десяти особей. Такое количество позволило специалистам собрать точные и надёжные научные данные. Учёные установили, что для защиты от вирусных заболеваний максимальная защита достигается при профилактическом применении препарата. В свою очередь, для лечения раковых опухолей оптимальным вариантом стала следующая схема: лекарство вводили раз в четыре дня. Именно такой промежуток идеально соответствовал естественной реакции организма на повторную стимуляцию выработки защитных белков — интерферонов.
При исследовании влияния исРНК на терапию злокачественных новообразований клетки меланомы вводили мышам подкожно, чтобы проследить рост первичной опухоли. Метастазы изучали, внедряя опухоль внутривенно, при этом метастазы образуются главным образом в легких. Гепатома чаще метастазировала в печень и почки. Когда появлялось небольшое новообразование, животных делили на группы. Одним давали только иммуностимулирующую РНК с липидом, другим — цитостатик (препарат, подавляющий рост опухолевых клеток), третьим — оба препарата. Постоянно контролировали размеры опухолей, массу животных и показатели крови.
Затем гистологические препараты органов изучали под микроскопом, оценивая иммунную инфильтрацию, а также численную или объемную плотность патологических структур методом морфометрии. Изучение селезенки показывало интенсивность иммунного ответа, а анализ крови позволял увидеть изменение клеточного состава и концентрации цитокинов.
Метод лечения зависел от вида опухоли. Комбинированная терапия цитостатиками и иммуностимулирующей РНК оказалась лучшей для меланомы, поскольку одного лишь цитостатика зачастую недостаточно. При этом способ введения молекулы в организм играет ключевую роль. Дело в том, что сама по себе РНК нестабильна и быстро разрушается в кровотоке, для активации защитных свойств она должна проникнуть внутрь клетки. Решением становится использование специальных переносчиков — катионных липосом. Различные составы липидных комплексов влияют на активность иммуностимулирующей РНК. Одни способствуют максимальному производству защитного белка — интерферона и обеспечивают лучшее противовирусное воздействие, другие лучше подходят для уничтожения раковых клеток. Каждый случай требует своего подхода к доставке активного компонента.
«Мы продолжаем изучать, насколько разные типы опухолей чувствительны к лечению иммуностимулирующими РНК. Наша главная задача — определить, какие виды онкологии эффективнее всего отвечают на такое лечение, и выявить биологические признаки, предсказывающие их реакцию. Так мы сможем точнее выбрать область применения наших разработок. Это исследование проводится в рамках проекта РНФ № 19-74-30011», — подчеркнула Елена Черноловская.
Материал подготовлен при поддержке гранта Минобрнауки России в рамках Десятилетия науки и технологий.
Текст: Ирина Баранова.
Источник: «Наука в Сибири».