Хемогенетически индуцированный окислительный стресс в нейронах снижает синаптическую пластичность
Хемогенетически индуцированный окислительный стресс в нейронах снижает синаптическую пластичность
Сотрудники Группы редокс-биологии и Лаборатории молекулярных технологий Отдела метаболизма и редокс-биологии ИБХ РАН совместно с коллегами из ФЦМН ФМБА России и РНИМУ им. Н.И. Пирогова показали на модели долговременной потенциации, что окислительный стресс в нервных клетках подавляет синаптическую пластичность.
Для проведения исследований были созданы вектора на основе аденоассоциированных вирусов для доставки и экспрессии дрожжевой оксидазы D-аминокислот (DAAO) (EC-1.4.3.3), ее инактивированного мутанта DAAO(R285A), используемого в качестве контроля, и генетически кодируемого флуоресцентного сенсора HyPer7 на пероксид водорода в нервных клетках. Этот фермент катализирует реакцию окислительного дезаминирования D-аминокислот, побочным продуктом которой является пероксид водорода.
Полученными векторами заражались первичные культуры нейронов и астроцитов из эмбрионального мозга мышей, и с использованием имиджинга в режиме реального времени было показано, что добавление D-аминокислоты D-норвалина к клеткам, которые экспрессируют активный фермент, приводит к продукции в нейронах пероксида водорода.
Для исследования влияния хемогенетически продуцированного пероксида водорода на синаптическую связь вектора с активной или неактивной DAAO стереотаксически вводили в область поля СА1 гиппокампа мышей. Затем на модели переживающих срезов мозга с применением методов электрофизиологии мы вызывали так называемую долговременную потенциацию (ДВП) – явление, при котором происходит стойкое увеличение амплитуды возбуждающих постсинаптических токов в ответ на определённый паттерн пресинаптической стимуляции.
Долговременная потенциация в пирамидных нейронах поля СА1 гиппокампа считается одной из форм клеточной памяти. В этих экспериментах было показано, что при доставке D-норвалина в среду, омывающую срезы, или напрямую в нейрон через патч-пипетку ДВП в нейронах с активным ферментом возникает, но с заметно меньшей амплитудой, которая вскоре падает до базального уровня.
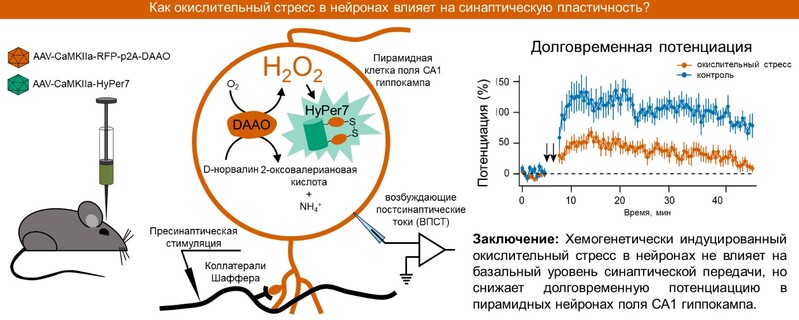
Этот результат показывает, что окислительный стресс препятствует формированию памяти на клеточном уровне, и вероятно объясняет нарушения когнитивных функций при старении мозга, которые возникают до явной нейродегенерации. Сочетание хемогенетической продукции пероксида водорода в нейронах и электрофизиологического исследования синаптической связи на переживающих срезах мозга является платформой для скрининга фармакологических препаратов, эффективных против окислительного стресса в нейронах.
Работа опубликована в журнале Redox Biology.
Источник: ИБХ РАН.