Магнитные нанокапсулы доставляют лекарство к опухолям
Магнитные нанокапсулы доставляют лекарство к опухолям
Сотрудники Института химической биологии и фундаментальной медицины СО РАН совместно с коллегами из онкологической больницы при Медицинском университете Гуанчжоу (Китай) создали нейлоновые нанокапсулы для доставки лекарств к опухолям. В основе одних капсул — магнитные наночастицы, что позволяет использовать их в МРТ-диагностике и лечении с помощью локальной гипотермии. Другие полые, и это дает возможность вмещать больше препарата и воздействовать на онкологические новообразования наименее токсично. Результаты исследования опубликованы в Magnetochemistry.
Магнитные наночастицы считаются перспективным направлением для лечения глиом. У них есть два важных преимущества. Во-первых, они управляются внешним магнитным полем, во-вторых, под воздействием переменного магнитного поля разогреваются и вызывают локальный перегрев, с помощью которого можно добиться гибели опухоли.
Однако у магнитных наночастиц (речь идет о смешанном оксиде железа Fe3O4) есть несколько особенностей, которые пока затрудняют их повсеместное использование. Сами по себе в чистом виде они нестабильны и достаточно быстро самопроизвольно переходят в Fe2O3. Это соединение теряет часть магнитных свойств и приобретает токсичность: уходя в кровоток, ионы железа вступают в окислительно-восстановительные реакции и вызывают появление активных форм кислорода, которые могут повреждать ДНК.
Второй недостаток магнитных наночастиц в том, что в водной среде они способны сильно агрегировать, то есть слипаться между собой. В итоге исходные наночастицы размером 10—20 нанометров превращаются в агрегаты величиной 100—150, а то и 500 нанометров. Из-за этого становится невозможным их внутривенное введение. Слишком большие частицы могут забивать мелкие капилляры и приводить к тромбозам, поэтому в биологии есть строгое ограничение на размер наночастиц, которые можно применять внутривенно, — не более 200 нанометров.
«В этом исследовании для работы с наночастицами мы использовали полимер нейлон-6 (он же капрон) — это тот самый материал, который применяется при изготовлении колготок. Он полностью биосовместим, биоразлагаем, нетоксичен и уже применяется в биомедицинских целях, например из него делают хирургические нити. Оказалось, если на наночастицу нанести капроновое покрытие, то, во-первых, можно стабилизировать поверхность. Во-вторых, нейлон-6 формирует трехмерную пористую матрицу. За счет того, что в этом полимере есть несколько хорошо реакционноспособных функциональных групп, к нему можно что-то химически присоединить», — рассказывает заведующая лабораторией биомедицинской химии ИХБФМ СО РАН кандидат химических наук Елена Владимировна Дмитриенко.
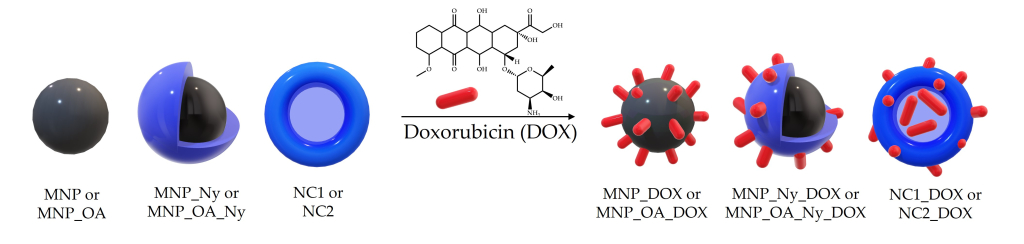
Полученные учеными скопления наночастиц, покрытых нейлоном, имеют размер до 200 нанометров. Было показано, что в течение полугода такие агрегаты абсолютно стабильны: у них не меняются размер, поверхностный потенциал и другие физические характеристики. Благодаря развернутой полимерной структуре лекарства в такие соединения помещается гораздо больше, а также увеличивается время его удержания в капсуле — важное преимущество для адресной доставки препарата.
Ученые рассчитывают, что их разработка будет использована в том числе для лечения глиом — агрессивных опухолей мозга. Размер нанокапсул позволяет проникать через гематоэнцефалический барьер, уже поврежденный опухолью в результате бурного роста.
Однако у магнитных частиц есть и серьезные недостатки. Например, в европейских странах начали отзывать препараты на их основе, поскольку проявились долгосрочные токсичные эффекты: оказалось, что они способны вызывать мутации, которые приводят к возникновению опухолей. И хотя наночастицы со временем разлагаются в виде солей железа, эти соли могут запускать формирование активных форм кислорода, которые, в свою очередь, способны спровоцировать онкологию.
«У нас появилась идея сделать из полимерного покрытия полую капсулу, лишенную магнитного ядра. У такой капсулы нет магнитных свойств, ею нельзя управлять на расстоянии магнитным полем и не получится вызвать с ее помощью локальный разогрев. Но зато в нее можно поместить лекарственный препарат, — говорит Елена Дмитриенко. — Мы получили магнитные наночастицы, стабилизировали их нейлоном, а потом кислотной обработкой растворили магнитную частицу внутри этого композита. В итоге у нас осталась только нейлоновая оболочка с пустотой внутри. В водных условиях эта капсула набухает, и внутрь попадают вещества. В статье показано, что она обладает достаточно большой емкостью для загрузки лекарственного препарата внутрь».
Для получения полой капсулы необходима основа (кор), иначе формируется полимерная частица без полости внутри. В качестве такого ядра, которое потом удаляется, можно использовать деградируемые материалы, в данном случае наночастицы оксида железа.
Поскольку нейлон может быть легко модифицирован дополнительными агентами, перед исследователями открывается возможность химически присоединить к нему лиганд — молекулу, которая будет специфично взаимодействовать с рецепторами онкотрансформированных клеток и тем самым обеспечивать адресную доставку нанокапсул непосредственно к опухолевым клеткам.
Науке известно множество способов отличить раковую клетку от здоровой. Благодаря тому, что опухолевая клетка начинает активно перестраивать свой метаболизм, у нее на поверхности появляются дополнительные рецепторы. Эти рецепторы для многих видов рака уже определены, и именно на них нацелены таргетные препараты. Можно подобрать лекарство, которое будет, как ключ к замочку, подходить именно к раковым клеткам определенного типа. Они сами будут вылавливать препарат из кровотока, связывать и всасывать внутрь.
Ученые продемонстрировали, что нейлоновые капсулы высвобождают лекарственный препарат pH-зависимо. Если в кровотоке нейтральный, физиологический pH, 7,35—7,45, то у онкологических клеток из-за активного деления он заниженный, то есть они кислее, чем здоровые. Исследователи показали: чем кислее pH, тем активней высвобождается лекарство из нанокапсул.
В качестве лекарственного препарата в эксперименте использовался доксорубицин. Он известен с середины прошлого века и до сих пор является препаратом номер один в клинической практике для лечения онкологических заболеваний. Этот препарат токсичный, плохо усваивается опухолью, поэтому разработка методов его таргетной доставки очень актуальна.
Сегодня в мире развиваются методы комплексного воздействия на опухоль с помощью противоракового антибиотика и препаратов на основе терапевтических нуклеиновых кислот. «Здесь нейлоновые нанокапсулы тоже могут быть полезны. У нас разработаны подходы для присоединения нуклеиновых кислот к нейлону, а в лаборатории биохимии нуклеиновых кислот ИХБФМ СО РАН есть кандидаты в нуклеиновые кислоты, для которых показано, что их проникновение в клетку приводит к подавлению раковой опухоли», — рассказывает Елена Дмитриенко.
В планах ученых — подобрать вещества-агенты для таргетной доставки нанокапсул и прикрепить их к нейлоновой оболочке. «Мы планируем собрать основу, и когда уже будет показано, что и носитель, и лекарственный препарат, и адресная составляющая представлены в одном наборе, который стабилен и нетоксичен, можно будет начинать исследования in vivo», — отмечает Елена Дмитриенко.
Текст: Диана Хомякова
Иллюстрации предоставлены исследователями
Источник: «Наука в Сибири»