Озаренные светом: вернуть зрение слепым взялись оптогенетики
Озаренные светом: вернуть зрение слепым взялись оптогенетики
Только в легендах незрячим возвращали способность видеть: миг – и готово. Сегодня сказку сделать былью пытаются ученые, представляющие новое, бурно развивающееся направление – оптогенетику. Она объединяет физиологов, генных инженеров и оптиков. В нашей стране ее возможности развивают во многих лабораториях. Перспективную команду из исследователей нескольких академических институтов собрали академики РАН М. Кирпичников и М. Островский. Рассказать об удивительных возможностях новой сферы науки «Поиск» попросил Михаила Островского, заведующего лабораторией Института биохимической физики им. Н. М. Эмануэля РАН, президента Физиологического общества им. И. П. Павлова.
– Оптогенетика еще очень молода, ей всего лет 15, от силы 20. Но ее предыстория весьма длинная, неожиданная и прелюбопытная. На ум приходят слова Шекспира: «Есть многое на свете, друг Гораций, что и не снилось нашим мудрецам». Еще раз подчеркну, это всего лишь новый, чрезвычайно перспективный метод. Ни наши, ни чужие мудрецы его рождения не предсказывали. А началось все 160 лет назад, когда академик Андрей Сергеевич Фаминцын, занимаясь одноклеточными водорослями, обнаружил, что они реагируют на свет, даже плывут к нему. Прошло еще около ста лет, и в конце 1970-х годов прошлого века на биологическом факультете Московского университета профессор Феликс Федорович Литвин с молодыми сотрудниками установил, что движениями этих одноклеточных водорослей управляет древнейший светочувствительный белок родопсин, очень похожий на зрительный белок человека с тем же названием. Он находится в зрительных клетках сетчатки глаза и отвечает за ее чувствительность к свету. Родопсин – ключевая молекула зрения. Работу биологов Московского университета, казалось бы, не имеющую практического значения, опубликовал журнал Nature.
Минуло еще четверть века, и немецкие биологи ввели ген родопсина в культуру обыкновенных клеток. В них образовался светочувствительный белок, получивший название канального родопсина. Прошло не более двух-трех лет, когда американские ученые доставили ген канального родопсина теперь уже в нервную клетку мозга мыши. В результате клетка приобрела светочувствительность. Оставалось только осветить ее, чтобы перевести в состояние физиологического возбуждения. Но как доставить свет в мозг? Пришлось в черепе мыши просверлить отверстие и вставить в него световод. Так с помощью света удалось возбуждать и тормозить определенные нейроны мозга. Физиологи получили возможность устанавливать связи между нейронами, исследовать механизмы обработки информации в мозге, механизмы памяти при неврологических и психических заболеваниях. Фактически оптогенетика произвела революцию в экспериментальных и фундаментальных исследованиях работы здорового и больного мозга. Но речь о лечении различных заболеваний, при всем желании, не шла: не будешь же делать трепанацию черепа, чтобы доставить свет к клеткам мозга человека! Единственная область медицины, в которой можно дойти до клиники, – это офтальмология. Ведь свет в клетки сетчатки глаза попадает естественным путем.
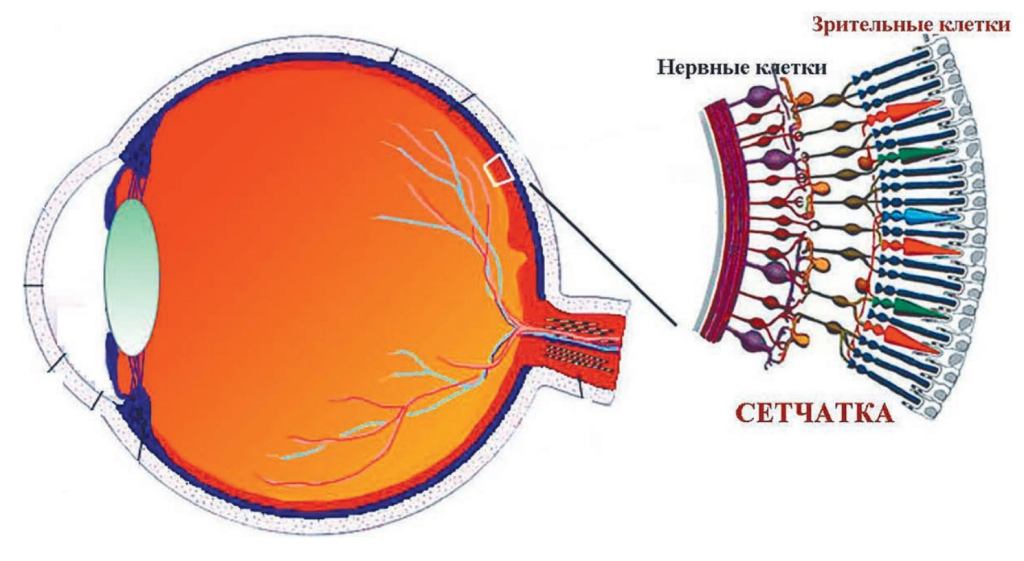
Первая работа на слепых мышах появилась в 2006 году. Это были генетически модифицированные мыши, у которых нет светочувствительных зрительных клеток. Человек слепнет потому, что у него погибли зрительные клетки сетчатки. Она, как пирожное «Наполеон», состоит из нескольких слоев клеток – светочувствительных зрительных и лежащих за ними нервных, несветочувствительных. При нейродегенеративных заболеваниях сетчатки, когда зрительные клетки погибли, ее нервные клетки, в общем-то, остаются здоровыми. Группа из Филадельфии, опубликовавшая первую работу, смогла доставить ген канального родопсина в неповрежденные нервные клетки сетчатки, и они, от природы несветочувствительные, ответили на свет физиологической активностью. Это означало, что они способны посылать зрительную информацию в мозг. Иными словами, открылась принципиальная возможность возвращать зрение слепым людям. В последующих работах было показано, что не только электрические ответы сетчатки и мозга восстанавливаются после такого оптогенетического протезирования, но и само поведение экспериментального животного. Понадобилось еще около 15 лет, чтобы приступить к клиническим испытаниям на человеке. Сейчас в мире одновременно ведутся четыре такие исследования. Самое сложное (и пока непреодолимое для нашей группы) – это получить разрешение Минздравов своих стран на испытания. Вперед вырвалась группа ученых из Швейцарии и Франции. Вот как они написали о своем успехе в журнале Nature за 2021 год: «Вначале пациент смог разглядеть пешеходный переход и сосчитать количество белых полос. Позже увидел тарелки, кружки, телефон, предметы мебели в комнате, двери в коридоре, но только при использовании очков». Это первый случай частичного восстановления зрения при нейродегенеративном заболевании с помощью оптогенетического протезирования.
Но не все так просто. На самом деле очки – сложнейшее миниатюрное электронно-оптическое устройство, снабженное камерой. Без них пациент не видел. И вот почему. Во всех четырех клинических испытаниях в качестве «инструмента» для протезирования используется канальный родопсин из одноклеточных водорослей. Конечно, сегодня это генно-инженерно-модифицированный, сильно улучшенный, но все же водорослевый канальный родопсин. И как «инструмент» для исследования сетчатки он не очень подходит. Его принципиальный недостаток – низкая светочувствительность. В ответ на свет канал открывается, начинает пропускать в клетку ионы и тем самым ее возбуждает или тормозит. Для этого нужно довольно много света. Мозг от его избытка, в общем-то, не пострадает, а вот сетчатка может быть повреждена. Проблема излишнего воздействия света – одна из актуальных в современной офтальмологии и гигиене зрения. Поэтому франко-швейцарской группе и пришлось разрабатывать очень сложное электронно-оптическое устройство в виде очков, чтобы не повредить сетчатку слишком сильным светом. Это важно, поскольку больная сетчатка намного чувствительнее к фотоповреждению, чем здоровая. Иначе получается, что одно лечим, другое калечим.
– И где же выход?
– В использовании естественного родопсина зрительных клеток сетчатки – его палочек и колбочек. В отличие от канального родопсина одноклеточных водорослей зрительный не канал, а профермент. Под действием света он активируется и запускает в клетке каскад усилительных ферментативных реакций, что также приводит к ее физиологическому возбуждению. В результате чувствительность протезируемой нервной клетки сетчатки к свету становится в тысячу раз выше, чем в случае применения канального родопсина водорослей.
– Но если естественный родопсин не сумели использовать раньше, значит, это очень сложно?
– Верно. Однако будущее в оптогенетическом протезировании слепой сетчатки, сейчас это становится очевидным, все-таки не за водорослевым, а за зрительным родопсином. Вот этим наша группа (и не только она) сейчас и занимается. Скоро будет опубликована статья о «прозрении» слепых мышей, в нервные клетки сетчатки которых нам удалось ввести такой родопсин. Необходимы дальнейшие генно-инженерные работы, фундаментальные физиологические и поведенческие исследования на животных, чтобы довести до клинических испытаний зрительный родопсин в качестве «инструмента» для протезирования. Он должен быть близок к естественному глазному родопсину. Суть же метода оптогенетического протезирования при этом не меняется. Это доставка гена безопасным, применяемым в клинике аденоассоциированным вирусом. И в случае успеха очки пациенту уже не понадобятся. Но, как и при испытаниях франко-швейцарской группы, ему предстоит пройти длительный курс «обучения», буквально заново научиться видеть. Так что впереди долгий и сложный путь исследований. Сейчас у нас закончился трехлетий грант Минобрнауки. Большое спасибо ему за это. Но будут ли еще деньги – большой вопрос. Набравшая темп сработавшаяся команда очень на это рассчитывает.
– Сколько приблизительно потребуется времени, чтобы лечить слепоту в обычных клиниках?
– Боюсь ошибиться. Думаю, меньше десяти лет, возможно, пять-шесть. Тогда в глазные клиники придут пациенты с потерей зрения в связи с нейродегенеративными заболеваниями сетчатки. И если пациент слеп, поскольку у него погибли зрительные клетки, а нервные в порядке, то ему предложат оптогенетическое протезирование. В случае успеха, но не сразу, он сможет различать обстановку в квартире, а на улице – автомобили и пешеходные переходы. Увидит своих детей и внуков, а для слепого человека это огромное счастье. Но вряд ли сможет читать или работать на компьютере.
Работа ученым и медикам предстоит огромная. По данным авторитетного журнала Lancet на 2017 год, в мире примерно у 285 миллионов человек по разным причинам нарушено зрение. Из них 39 миллионов считаются слепыми. Более четверти от всего количества слепых людей страдает от нейродегенеративных заболеваний сетчатки, когда гибнут зрительные клетки. По прогнозу, в ближайшие десятилетия эти цифры будут существенно расти. Человечество стареет, и проблем со зрением становится все больше.
Источник: газета «Поиск».
Подготовил Юрий Дризе.