Подавление онкологических заболеваний воздействием на клеточные рецепторы EGFR
Подавление онкологических заболеваний воздействием на клеточные рецепторы EGFR
Злокачественные опухоли остаются одной из главных причин смертности и каждый год уносят миллионы жизней. К счастью, учёные многое узнали о развитии таких болезней и о том, как подавить рост опухоли, подействовав на её особые клетки.
Российские исследователи из Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН, Московского физико-технического института и Сеченовского университета подготовили обзорную статью для журнала Cells, в которой рассказали о важных для лечения онкологических заболеваний клеточных рецепторах EGFR. Авторы также описали арсенал современных препаратов, действующих на такие белки — как уже используемых в клинике, так и разрабатываемых.
Онкологические заболевания — это тяжёлые и опасные болезни, которые ежегодно приводят к смерти миллионов людей. Они поражают разные органы, отличаются по угрозе для жизни и возникают из-за ряда причин. Главными факторами риска считают образ жизни (в том числе вредные привычки), загрязнение окружающей среды, а также наследственность.
За последние десятилетия учёным удалось многое узнать о молекулярных механизмах развития рака, наметился и прогресс методов лечения. Если раньше пациенты были вынуждены соглашаться на опасные химио- и радиотерапию или операцию, то сейчас врачи располагают также арсеналом более безопасных и избирательных средств.
В случае многих опухолей особое значение имеют белки-рецепторы семейства эпидермального фактора роста (EGFR). Поэтому учёные из МФТИ, ИБХ РАН и Сеченовского университета подготовили обзорную статью для журнала Cells, в которой суммировали имеющиеся данные о EGFR и препаратах, которые подавляют их активность.
Рецепторы EGFR представлены четырьмя группами белков, которые расположены на мембране различных клеток и регулируют их активность. Такие молекулы можно сравнить с рычагами или тумблерами, которые управляют внутриклеточными процессами, запуская каскады взаимодействий между молекулами. Активация («включение») EGFR обычно начинается со связывания специфического лиганда, который вызывает объединение белков в пары (димеризацию) и приводит в действие их внутриклеточную часть — так называемый киназный домен. Он работает как фермент-тирозинкиназа — присоединяет остатки фосфорной кислоты к определённым частям белков, в том числе самого рецептора. За этим следует эффект на другие белки внутри клетки, которые и сами запускают вторичные, третичные реакции и так далее.
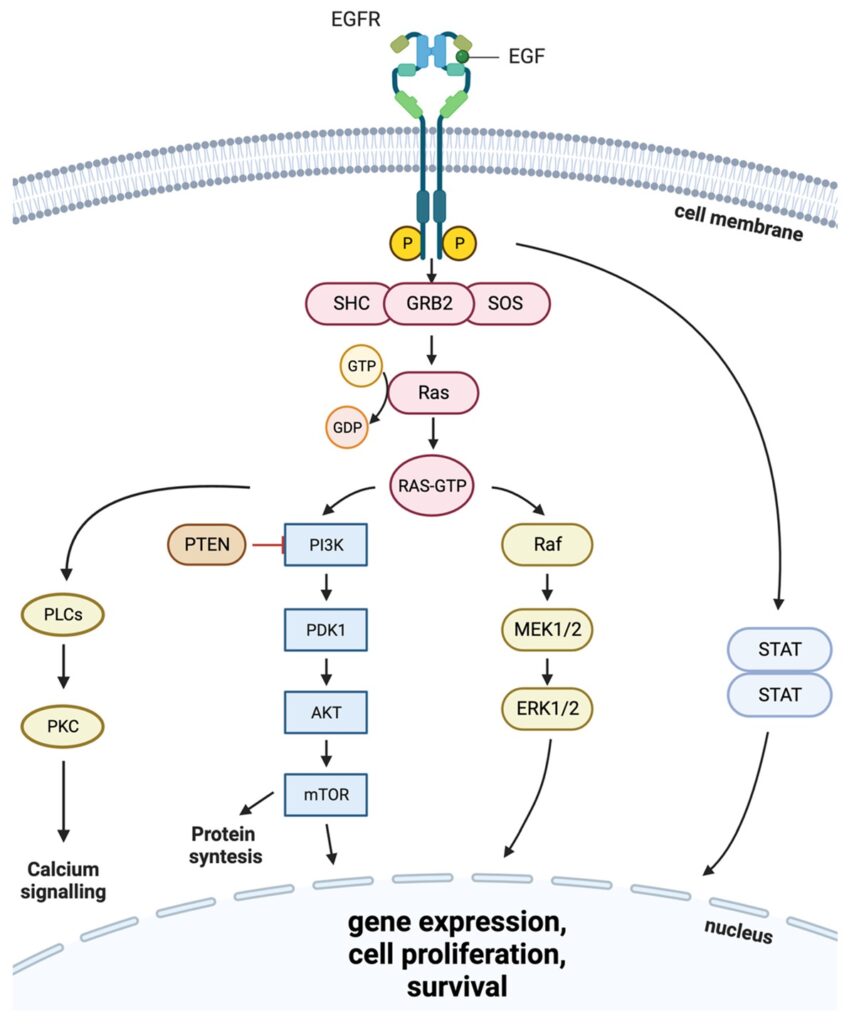
К сожалению, в случае онкологических заболеваний активация EGFR оборачивается неконтролируемым ростом злокачественных клеток и их «отказом» уходить в апоптоз, то есть программируемую клеточную смерть. Мутации EGFR вызывают карциномы (самый распространенный тип рака), рак головы и шеи, легкого, молочной и поджелудочной желез и толстой кишки. Они также связаны с тяжёлым течением болезни и высокой смертностью.
Авторы статьи подчеркнули, что в лечении таких недугов наметился несомненный прогресс. За последние десятилетия созданы более безопасные и избирательные лекарства, которые делятся на две группы — «нибы» и «мабы».
«Мабы» (mAbs, от английского «моноклональные антитела») — это полученные искусственно крупные белки, которые обычно работают в иммунной системе и помогают ей распознавать патогены и прочие угрозы. Антитела очень специфично связывают целевые молекулы EGFR и мешают им захватывать лиганд, образовывать пары и в целом активироваться.
«Нибами» (nibs, от английского «inhibitors») называют малые молекулы, сравнительно небольшие органические соединения, которые взаимодействуют с рецепторами EGFR и подавляют их активность. Это пример избирательного и персонализированного лечения, которое учитывает мутации у конкретного пациента. На сегодняшний день созданы четыре поколения таких препаратов: новые призваны преодолеть недостатки предшественников. Первым лекарством группы стал гефитиниб, разработанный еще в 1990-х годах, однако вскоре возникла необходимость в новых препаратах.
«Спустя некоторое время после начала лечения геном опухоли мутирует, так что белок EGFR становится невосприимчив к препарату, а опухоль снова растет. Но для таких мутаций ученые тоже разработали новые специфические лекарства. Они связываются с другими частями белковой молекулы EGFR и опять блокируют ее, но уже по-другому. И снова опухоль сначала отвечает на лечение, а через несколько месяцев или год выжившие раковые клетки приобретают мутации, которые опять делают EGFR невосприимчивым к лечению. И снова есть новое поколение препаратов на этот случай. И снова происходят мутации… Всего разработано уже четыре поколения таких специфичных, или “таргетных” препаратов против EGFR, и продолжают появляться новые. Вместе они способны существенно продлить жизнь больному», — подытожил один из авторов Антон Буздин, профессор РАН, руководитель лаборатории трансляционной геномной биоинформатики МФТИ и Группы геномного анализа сигнальных систем клетки ИБХ РАН.
Текст: Михаил Орлов.
Источник: «За науку».