Получена серия противовирусных соединений и изучен механизм их действия
Получена серия противовирусных соединений и изучен механизм их действия
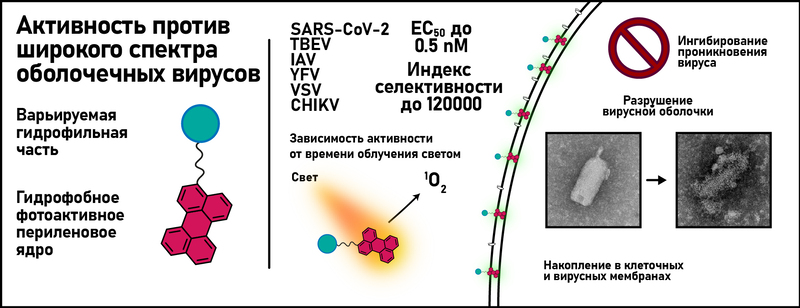
Группа учёных из Лаборатории молекулярного дизайна и синтеза, Группы экспрессии белковых факторов роста и дифференцировки ИБХ РАН, Института полиомиелита и других институтов синтезировали серию соединений на основе 5-(перилен-3-илэтинил)урацила и изучили их противовирусные свойства и механизм действия. Предыдущие исследования данного класса соединений предполагали противоречащие типы механизмов действия при сопоставимо высокой активности. Настоящее исследование показало, что при облучении светом амфифильные соединения, аккумулированные в клеточных и вирусных мембранах, ингибируют проникновение в клетку оболочечных вирусов.
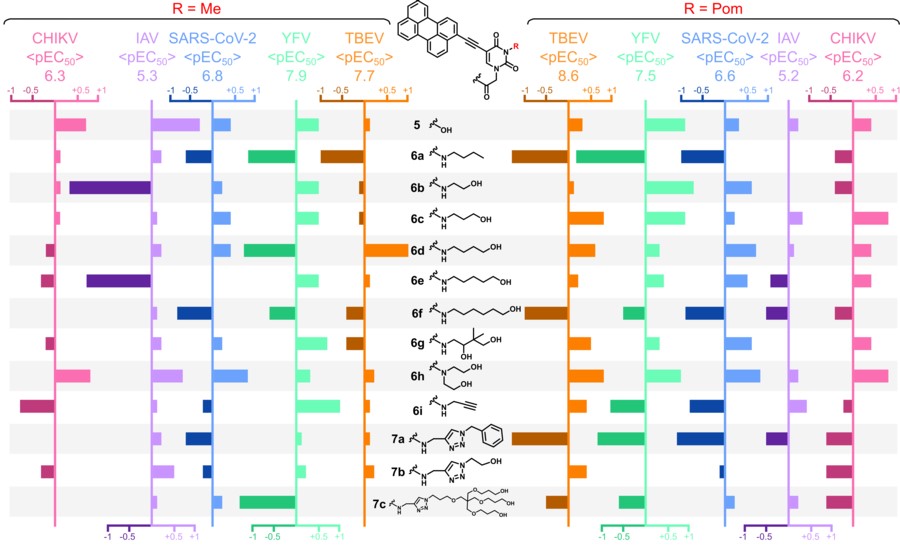
Амфипатические нуклеозидные и ненуклеозидные производные пентациклического ароматического углеводорода перилена известны как сильнодействующие нецитотоксические противовирусные средства широкого спектра действия. В данной работе сообщается о 3-метил-5-(перилен-3-илэтинил)-урацил-1-уксусной кислоте и ее амидах, новой серии соединений на основе 5-(перилен-3-илэтинил)-урацила. Соединения демонстрируют выраженную активность in vitro в отношении переносимых членистоногими вирусов, а именно вируса клещевого энцефалита (ВКЭ) и вируса желтой лихорадки (ЖЛ), в анализах на уменьшение бляшек со значениями ЕС до 1,9 и 1,3 нМ соответственно, а также вируса чикунгунья (CHIKV) в тесте ингибирования цитопатического эффекта со значениями ЕС до 3,2 мкМ. Соединения были активны и в отношении респираторных вирусов: ингибировали коронавирус (SARS-CoV-2), в тесте ингибирования цитопатического эффекта и вирус гриппа А (IAV) в экспериментах по снижению титра вируса – значения ЕС до 51 нМ и 2,2 мкМ соответственно (Рисунок 2).
Активность определяется наличием гидрофобного периленового ядра (Рисунок 1), все синтезированные соединения показали сопоставимые скорости генерации синглетного кислорода 1О2. Тем не менее активность может варьироваться на порядки в зависимости от гидрофильной части молекулы, что указывает на сложный механизм действия (Рисунок 2).
Эксперимент по времени добавления и флуоресцентная визуализация показывают, что соединения ингибируют проникновение вирусов в клетки. Локализация соединения в липидных бислоях и видимое повреждение вирусной оболочки предполагают мембрану в качестве первичной мишени. Резкое снижение противовирусной активности при ограниченном доступе света или при добавлении антиоксидантов подтверждает идею о фотоиндуцированном АФК-опосредованном повреждении вирусной оболочки как способе противовирусного действия.
Исследование опубликовано в журнале Antiviral Research.
Источник: ИБХ РАН.