Представлена новая модель строения миелиновых оболочек нейронов
Представлена новая модель строения миелиновых оболочек нейронов
Результаты исследования учёных из Санкт-Петербургского филиала Института общей генетики им. Н.И. Ваваилова РАН и кафедры генетики Санкт-Петербургского государственного университета доказывают, что миелиновые оболочки нейронов содержат амилоидные фибриллы белка MBP. Наличие этих компактных и прочных структур может обеспечивать идеальную изоляцию аксонов для быстрого и эффективного проведения нервного импульса. Статья опубликована в журнале Scientific Reports.
Миелин — это электроизолирующая оболочка вокруг аксонов многих нейронов, обеспечивающая быстрое и эффективное проведение нервных импульсов. В головном мозге миелиновые оболочки образованы уплощенными отростками олигодендроцитов (разновидность глиальных клеток). Каждый олигодендроцит генерирует несколько отростков, которые могут связывать аксоны разных нейронов. Эти отростки распознают аксоны активно функционирующих нейронов и обвивают их. Изолированные отростки нейронов принято называть белым веществом головного мозга. Нарушение формирования миелиновых оболочек негативно влияют на память, обучение и скорость реакции. Воспалительные демиелинизирующие заболевания, такие как рассеянный склероз, вызывают нейродегенеративные поражения ЦНС.
Формирование миелиновой оболочки вокруг аксона сопровождается уплощением отростков олигодендроцитов — в этих отростках расстояние между мембранами составляет всего 3 нм. Было показано, что белок МВР связывает противоположные мембраны, прикрепляясь к ним N- и C-концами. Между мембранами с помощью электронной микроскопии выявляется так называемая электронно-плотная линия. Однако механизм компактизации миелина долгое время оставался загадкой.
Этот вопрос стал предметом исследования. Авторы показали, что молекулы белка МВР внутри отростков олигодендроцитов объединяются в амилоидные фибриллы.
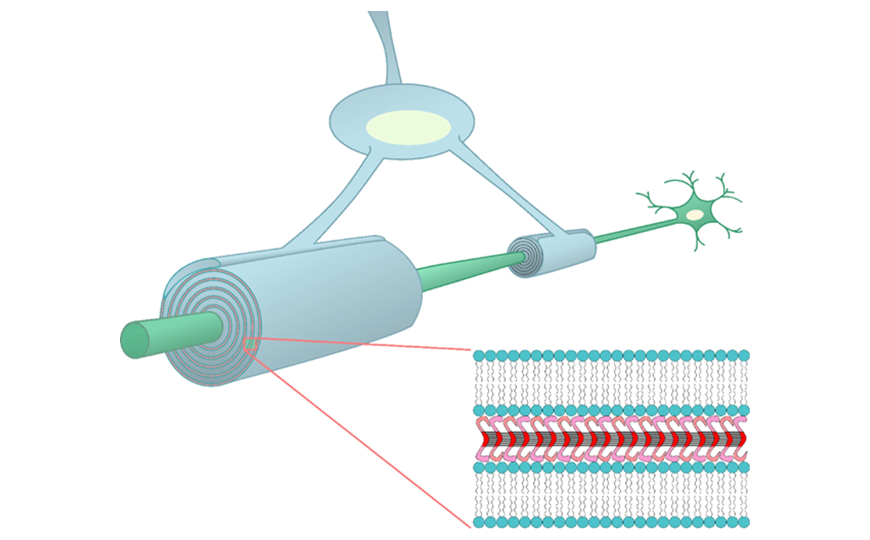
Амилоидные фибриллы представляют собой особый тип укладки белка. Молекулы в составе таких фибрилл соединенены водородными связями, образуя так называемые кросс-бета структуры. Некоторые белки формируют цитотоксичные амилоидные фибриллы, что способствует развитию нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона. Однако белок МВР в норме представлен в виде амилоидных фибрилл, способствующих изоляции аксонов и проведению нервного импульса. Это было подтверждено с помощью ряда экспериментальных подходов.
Авторы показали, что белок МВР представлен в мозге в виде олигомеров и агрегатов, устойчивых к воздействию додецилсульфата натрия при комнатной температуре. Это вещество разбирает большинство белковых агрегатов и комплексов до мономеров, тогда как амилоидные фибриллы не разрушаются. Более того, на криосрезах головного мозга крысы в области стриатума зона локализации МВР окрашивается амилоидспецифичными красителями — конго красным и тиофлавином S. Колокализация МВР с тиофлавином S показана также на криосрезах мозга травяной лягушки, красноухой черепахи и домашней курицы. Эти данные позволяют полагать, что амилоидные свойства эволюционно-консервативного белка МВР характерны для всех позвоночных.
Вместе с тем цитологических данных недостаточно для идентификации белка, образующего амилоидные фибриллы. Дело в том, что помимо МВР миелин содержит и другие белки, которые теоретически могут связывать амилоидспецифичные красители. Для окончательного подтверждения амилоидных свойств исследуемого белка авторы с помощью оригинальной методики провели иммунопреципитацию и очистку нативных фибрилл МВР из мозга крысы. Полученные препараты белка эффективно связывали краситель конго красный и демонстрировали яблочно-зеленое двойное лучепреломление в поляризованном свете — это отличительная особенность всех известных амилоидных фибрилл. Также выделенный белок был окрашен первичными антителами к МВР и вторичными антителами, связанными с частицами золота размером 10 нм. Электронно-микроскопическое исследование показало, что белок, выделенный из головного мозга, представлен в виде фибриллярных структур. Эти данные окончательно доказывают, что электронно-плотная линия, которая выявляется в составе миелина, представляет собой не что иное, как амилоидные фибриллы белка МВР.
На модели дрожжей, а также в экспериментах in vitro, удалось установить, что за формирование фибрилл отвечает центральная область белка с 60-го по 119-й аминокислотный остаток.
«Таким образом, можно заключить, что белок МВР формирует амилоидные фибриллы в миелиновых оболочках нейронов. Амилоидные фибриллы МВР представляют собой компактные и очень прочные белковые структуры, которые, очевидно, обеспечивают идеальную изоляцию отростков нейронов. Это открытие позволило предложить новую модель строения миелина. В соответствии с этой моделью, молекулы MBP не только „склеивают“ мембраны отростков олигодендроцитов, но и прошивают их в продольном направлении», — прокомментировал руководитель работы, директор Санкт-Петербургского филиала ИОГен РАН Алексей Галкин.
Источник: ИОГен РАН.