Раскрыт механизм терминации трансляции
Раскрыт механизм терминации трансляции
Биосинтез белка рибосомой — важнейшая реакция в живой природе. Длина полипептидной цепи строго определена стартовым и стоп-кодонами в мРНК. Терминация трансляции необходима для своевременного окончания биосинтеза белка и высвобождения готового полипептеда из рибосомы. Этот процесс регулируется специальными белками, так называемыми «релиз-факторами», которые распознают стоп-кодоны и опосредуют гидролиз сложноэфирной связи в молекуле пептидил- тРНК, находящейся в каталитическом центре рибосомы. В новом исследовании показана роль релиз-фактора и 2'-OH группы тРНК в катализе обрыва цепи через образование «мостикового» циклического интермедиата. Работа опубликована в журнале Science.
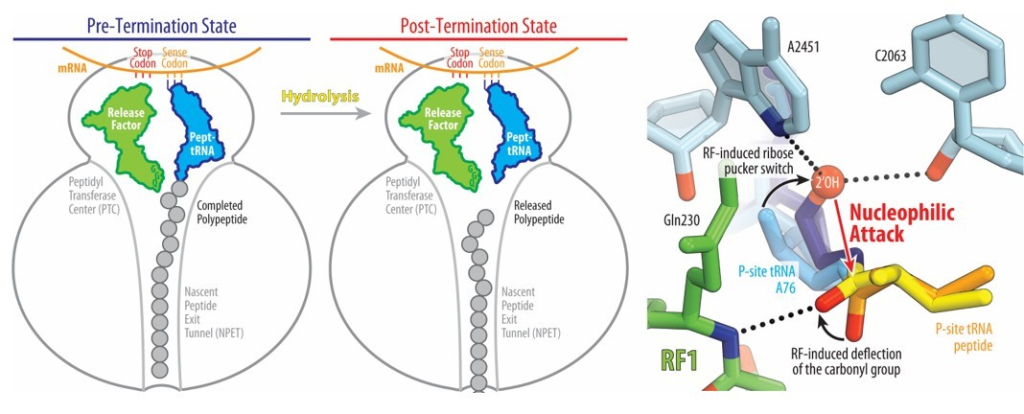
Преобладающая в области точка зрения заключалась в том, что релиз-фактор активирует молекулу воды, которая вступает в реакцию гидролиза сложноэфирной связи пептидил-тРНК. Получение стабильных производных пептидил-тРНК, в которых сложноэфирная связь заменена на амидную, позволило изучить кристаллическую структуру высокого разрешения комплексов рибосомы с мРНК, релиз-фактором и пептидил-тРНК в P-сайте, соответствующую «предгидролизному» состоянию.
Никакой молекулы воды, активируемой релиз-фактором, обнаружено не было. Вместо этого оказалось, что формируется водородная связь между амидным азотом основной цепи консервативного мотива релиз-фактора и карбонилом пептидил-тРНК. Это приводит к:- изменению конформации рибозы с C2'-эндо на C3'-эндо, позиционируя 2'-OH группу для нуклеофильной атаки по карбонильному углероду C-концевой аминокислоты;
- стабилизации образующегося «мостикового» циклического интермедиата.
Таким образом, новые структурные данные подсказали механизм терминации трансляции, в корне отличающийся от предполагавшегося ранее. Роль релиз- фактора состоит не в прямой активации молекулы воды, а в индукции особой конформации 3'-концевого нуклеотида тРНК, которая способствует активности собственного 2'-гидроксила, опосредующего гидролиз. Такая конформация не реализуется в ходе элонгации трансляции, исключая возможность преждевременной терминации.
Работа выполнена под руководством профессора Юрия Поликанова (Университет штата Иллинойс в Чикаго) и профессора М.Г. Ганьона (Университет штата Техас в Галвестоне). Авторы посвятили свою работу памяти своих наставников: лауреату Нобелевской премии за исследование структуры и функции рибосомы профессору Томасу Стейцу, и академику Александру Спирину, лидеру в изучении биосинтеза белка в России. В исследовании принял участие сотрудник Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН Андрей Василевский.
Источник: ИБХ РАН.