Выявлен новый механизм регуляции кальциевой ёмкости митохондрий
Выявлен новый механизм регуляции кальциевой ёмкости митохондрий
Учёные из Института теоретической и экспериментальной биофизики РАН выявили новый механизм регуляции связывания кальция в митохондриях печени крыс при разном соотношении адениновых нуклеотидов.
Механизм подразумевает участие транспортёров адениновых нуклеотидов и фосфата в регуляции кальций-связывающей способности митохондрий, что открывает новые перспективы для терапевтического воздействия при сердечно-сосудистых и нейродегенеративных заболеваниях.
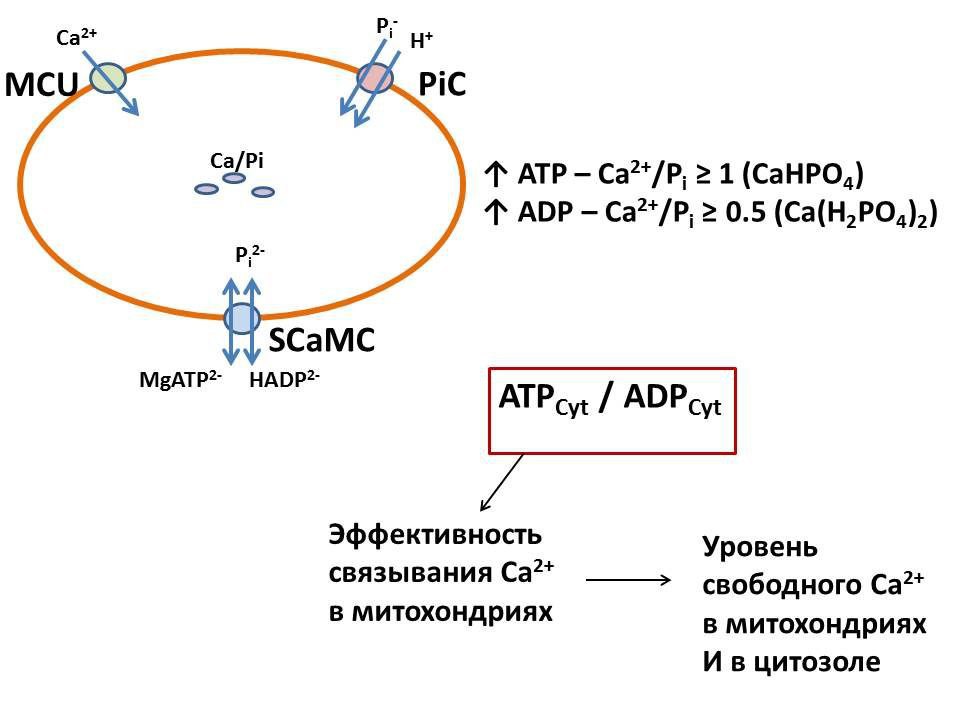
Ионы кальция (Ca2+) являются важнейшим элементом внутриклеточной сигнализации. Однако их избыток в цитоплазме может привести к необратимому повреждению и гибели клеток. Поэтому уровень Ca2+ в цитоплазме тонко регулируется: лишний отправляется в специальные депо — эндоплазматический ретикулум и митохондрии — или откачивается из клетки. Для связывания Са2+ в митохондриях необходимы анионы, в первую очередь, фосфат (Pi).
Ранее учёные показали, что Са2+ запасается в митохондриях в виде гранул гидроксиапатита или витлокита, в состав которых входит большое количество (до 10 %) адениновых нуклеотидов, таких как АТФ (аденозинтрифосфат, универсальный источник энергии в клетке) и АДФ (аденозиндифосфат, предшественник АТФ). Однако с этими данными связаны две проблемы. Во-первых, оба минерала практически нерастворимы в воде, тогда как митохондрии не только быстро связывают Са2+, но и могут его быстро высвобождать в определённых условиях (Са2+-буфер). Во-вторых, ранние работы проводились в условиях, которые неизбежно приводили к необратимому повреждению митохондрий кальцием и фосфатом, о чём стало известно значительно позже.
Учёные из Пущино исследовали связывание Са2+ в митохондриях печени крысы. Работу прокомментировал ведущий научный сотрудник Лаборатории тканевой инженерии ИТЭБ РАН, кандидат биологических наук Алексей Круглов:
«Одной из задач нашей работы была проверка соотношения ионов кальция, фосфата и адениновых нуклеотидов (АТФ, АДФ, АМФ), которые накапливаются в неповреждённых (интактных) митохондриях в присутствии физиологических концентраций АТФ/АДФ. Наши результаты показывают, что, во-первых, в интактных митохондриях адениновые нуклеотиды при аккумуляции Са2+ не накапливаются. Во-вторых, соотношение связанных Ca2+ и Pi может меняться в зависимости от того, что преобладает в среде, АТФ или АДФ. В присутствии АТФ отношение Ca2+/Pi в митохондриях близко к 1, что может являться физиологической нормой; в присутствии АДФ — стремится к 0,5, что указывает на ослабление Са2+-связывающей способности митохондрий в условиях близких к патологическим, когда уровень АТФ в клетке резко снижается».

По словам авторов, эти данные демонстрируют новую мишень для разработки терапевтических подходов к минимизации последствий состояний, связанных с временным повышением уровня ионов кальция и снижением уровня АТФ в клетке (ишемические эпизоды, эпилепсия и т. п.). В дальнейшем учёные планируют выяснить молекулярную природу данной мишени и подобрать фармакологические модуляторы для коррекции патологических состояний.
Результаты исследования опубликованы в статье в журнале Biochimica et Biophysica Acta (BBA) — Bioenergetics.
Текст: Алсу Дюкина.
Источник: пресс-служба ИТЭБ РАН.